
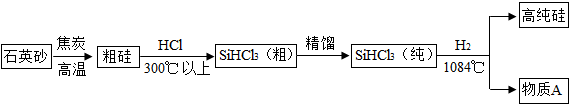
| ||
| ||


科目:初中化学 来源: 题型:
| 序号 | 待鉴别的物质 | 鉴别方法 |
| A | 氮气与二氧化碳 | 点燃的木条 |
| B | 氧化钙与硝酸铵 | 加水,测量溶液温度的变化 |
| C | 尿素和硫酸铵 | 加熟石灰,研磨 |
| D | 氧化铜与铁粉 | 用磁铁吸引 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、冰和干冰,组成元素不同-物质分类相同 |
| B、纯碱和烧碱,组成元素不同-物质分类相同 |
| C、金刚石和石墨,组成元素相同,原子排列不同-物理性质不同 |
| D、一氧化碳和二氧化碳,组成元素相同,分子结构不同-化学性质不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:
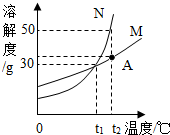 图中M、N分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( )
图中M、N分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( )| A、等质量M、N的饱和溶液,当温度从tl℃升高到t2℃后,所得溶液质量N>M |
| B、M、N两种饱和溶液,当温度从t2℃降到tl℃时,析出的晶体N>M |
| C、t2℃时150gN的饱和溶液降温至tl℃,则析出晶体30g |
| D、同处A点的相同质量的M、N两种溶液,当温度从t2℃降到tl℃后,剩余溶液的质量分数相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:
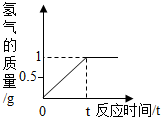 黄铜主要是由铜和锌组成的铜锌合金,它强度高,可塑性好,易加工,耐腐蚀.使用范围广.化学实验小组的同学想知道某种黄铜中铜和锌的含量,他们将100g黄铜磨成粉沫,然后放入盛有足量稀盐酸的烧杯中,反应生成氢气的量与时间的关系如图.试回答:
黄铜主要是由铜和锌组成的铜锌合金,它强度高,可塑性好,易加工,耐腐蚀.使用范围广.化学实验小组的同学想知道某种黄铜中铜和锌的含量,他们将100g黄铜磨成粉沫,然后放入盛有足量稀盐酸的烧杯中,反应生成氢气的量与时间的关系如图.试回答:查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
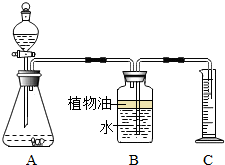 某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.
某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.查看答案和解析>>
科目:初中化学 来源: 题型:
| 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
| 加入氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
| 白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com