
| A. | 氯气只是一种氧化剂 | B. | 氯气只是一种还原剂 | ||
| C. | 氯气既是氧化剂也是还原剂 | D. | 氯气既不是氧化剂也不是还原剂 |
科目:初中化学 来源: 题型:解答题
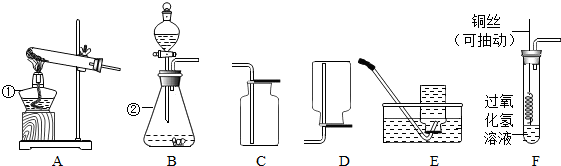
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铬原子 | B. | 三氧化二铬 | C. | 铬元素 | D. | 铬离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质名称 | 食盐 | 硫酸亚铁 | 熟石灰 | 硝酸 | 硫酸铝 |
| 化学式 | NaCl | FeSO4 | Ca(OH)2 | HNO3 | Al2(SO4)3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
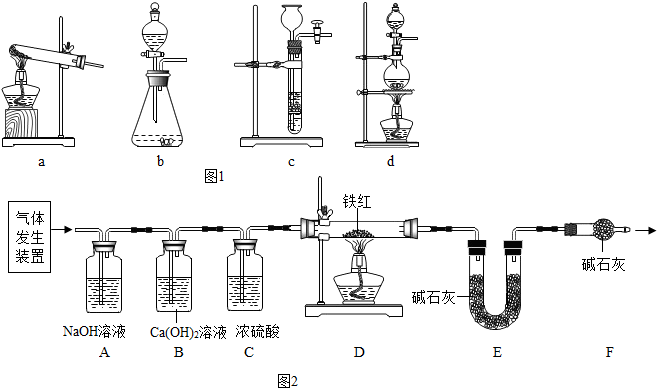
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
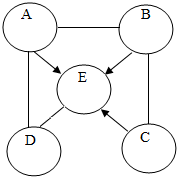 A、B、C、D、E分别为氧化铜、氢氧化钠溶液、稀盐酸、二氧化碳、碳中一种物质,通常状况下E为气体,如图,用圆圈表示这五种物质,用“-”表示两种物质可以反应,用“→”表示一种物质可以转化为另一种物质.
A、B、C、D、E分别为氧化铜、氢氧化钠溶液、稀盐酸、二氧化碳、碳中一种物质,通常状况下E为气体,如图,用圆圈表示这五种物质,用“-”表示两种物质可以反应,用“→”表示一种物质可以转化为另一种物质.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ①③④⑤ | C. | ①②⑥ | D. | ①⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com