
 如图所示,是A、B、C三种固体物质的溶解度曲线.
如图所示,是A、B、C三种固体物质的溶解度曲线.分析 (1)根据溶解度曲线分析解答;
(2)溶解度曲线的交点表示该温度下两物质的溶解度相等;一定温度范围内,溶解度随温度变化趋势越大,则析出晶体越多;
(3)据ABC三种物质的溶解度随温度的降低的变化情况分析解答;
(4)结合该温度范围内物质的溶解度,及溶液中溶质的质量分数计算式分析解答.
解答 解:(1)t1℃时,100g水中最多能溶解C物质20g;
(2)在t1℃时,AC溶解度曲线交于一点,二者的溶解度相等;t3℃时将A、B、C三种物质接近饱和的溶液通过降温后,C的溶解度随温度降低而增大,不会析出晶体,A的溶解度变化比B大,所以等质量的三种溶液能析出晶体且析出晶体最多的是A;
(3)AB的溶解度随温度的降低而减小,C的溶解度随温度的降低而增大,所以当A、B、C三种物质的饱和溶液从t3℃降温到t1℃,所得的溶液中仍然是饱和溶液的是AB;
(4)观察图示可知:t2℃时A的溶解度是30g,当温度控制在大于t1℃小于t2℃时,A的溶解度最大是30g,而B的溶解度始终大于30g,C的溶解度始终小于30g,所以在此温度范围内,所得溶液中溶质质量分数最大的是B;
故答案为:(1)20;(2)A;(2)A;B;(3)B.
点评 本题能很好的考查学生对溶解度曲线意义的认识,以及应用解题的能力,掌握相关知识才能结合选项很好的分析解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
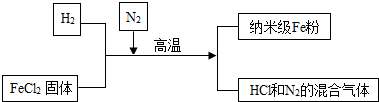
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 验证二氧化碳与水反应生成碳酸 | 向一个收集满二氧化碳的集气瓶中加入约$\frac{1}{3}$体积的水,再滴入几滴酚酞溶液,振荡 |
| B | 除去铁粉中的少量铜 | 加足量稀硫酸,再过滤、洗涤、干燥 |
| C | 验证被点燃的气体一定是氢气 | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯 |
| D | 氧气是可燃物燃烧的条件之一 | 将白磷浸没在热水中,再向热水中的白磷通氧气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
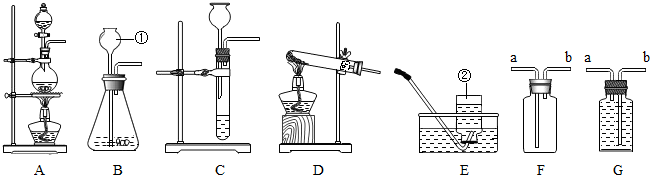
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 粗盐变成精盐 | B. | 工业上分离液态空气制得氧气 | ||
| C. | 蘸到浓硫酸的木棍即刻变黑 | D. | 打开浓盐酸瓶盖,从瓶口涌出白雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com