
| A. | X的化学式是SiF4 | B. | X是一种氧化物 | C. | 可能含有氧元素 | D. | 可能含有氢元素 |
分析 由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式,据此结合题意进行分析判断.
解答 解:根据反应的化学方程式SiO2+4HF═X↑+2H2O,反应物中硅、氧、氢、氟原子个数分别为1、2、4、4,反应后的生成物中硅、氧、氢、氟原子个数分别为0、2、4、0,根据反应前后原子种类、数目不变,则每个X分子由1个硅原子和4个氟原子构成,则物质X的化学式为SiF4.
A、由上述分析,X的化学式为SiF4,故选项说法正确.
B、由上述分析,X的化学式为SiF4,不含氧元素,不属于氧化物,故选项说法错误.
C、由上述分析,X的化学式为SiF4,不含氧元素,故选项说法错误.
D、由上述分析,X的化学式为SiF4,不含氢元素,故选项说法错误.
故选:A.
点评 本题难度不大,利用化学反应前后原子守恒来确定物质的化学式是正确解答此类题的关键.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 物质的量的单位是n | |
| B. | 摩尔是国际单位制中七个基本物理量之一 | |
| C. | 1mol二氧化碳分子中含有1mol碳原子和2mol氧原子 | |
| D. | 水的摩尔质量是18g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
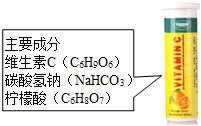 维C泡腾片是一种保健药品,主要成分见如图,将其溶于水会观察到有许多气泡产生.某小组同学对产生的气体进行研究.甲同学认为该气体可能是CO2、O2、CO、H2、N2.乙同学认为不可能是N2,其理由是反应物中不含氮元素,不符合质量守恒定律;丙同学认为不可能是CO或H2,因为从药品安全角度考虑,H2易燃易爆,CO有毒;检验该气体是否为CO2的方法为将气体通入澄清的石灰水中,观察石灰水是否变浑浊.
维C泡腾片是一种保健药品,主要成分见如图,将其溶于水会观察到有许多气泡产生.某小组同学对产生的气体进行研究.甲同学认为该气体可能是CO2、O2、CO、H2、N2.乙同学认为不可能是N2,其理由是反应物中不含氮元素,不符合质量守恒定律;丙同学认为不可能是CO或H2,因为从药品安全角度考虑,H2易燃易爆,CO有毒;检验该气体是否为CO2的方法为将气体通入澄清的石灰水中,观察石灰水是否变浑浊.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单质 | B. | 原子 | C. | 分子 | D. | 元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 10g | B. | 13.4g | C. | 20g | D. | 30g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
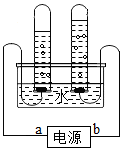
| A. | a、b分别是电源的负极、正极 | |
| B. | 在水中加入少许氢氧化钠,可以增强导电性 | |
| C. | 左边试管中收集到的气体能使带火星木条复燃 | |
| D. | 电解水实验说明,水是由氢元素和氧元素组成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.
如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com