
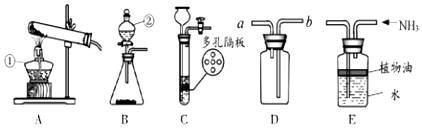
分析 酒精灯是常用的加热仪器,分液漏斗可以控制反应的速率;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.装置C的优点为:可以控制反应的发生和停止;若用碳酸钠粉末和稀硫酸反应制取CO2,则只能选择B装置,因为分液漏斗可以控制反应的速率.实验室可用加热熟石灰与氯化铵的固体混合物的方法制NH3,同时生成氯化钙和水,配平即可;用E装置收集氨气,其中植物油的作用是:防止氨气溶于水.
解答 解:(1)酒精灯是常用的加热仪器,分液漏斗可以控制反应的速率,故答案为:酒精灯;分液漏斗;
(2)如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;如果选择用D装置收集该气体,气体应从长管进入,因为氧气的密度比空气大;故答案为:A;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;b;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;装置C的优点为:可以控制反应的发生和停止;若用碳酸钠粉末和稀硫酸反应制取CO2,则只能选择B装置,因为分液漏斗可以控制反应的速率;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;可以控制反应的发生和停止;B;
(4)实验室可用加热熟石灰与氯化铵的固体混合物的方法制NH3,同时生成氯化钙和水,配平即可;用E装置收集氨气,其中植物油的作用是:防止氨气溶于水;故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;防止氨气溶于水;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:初中化学 来源: 题型:选择题
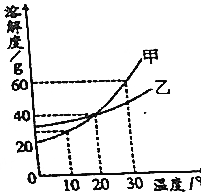
| A. | 10°C时,甲的溶解度大于乙的溶解度 | |
| B. | 甲中含有少量乙,要提纯甲,可用蒸发溶剂法 | |
| C. | 甲的饱和溶液由30°C降温到0°C,甲不能全部析出 | |
| D. | 30°C时,20g乙溶于50g水中能形成饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是a、b、c三种固体物质的溶解度曲线图,根据曲线图回答下列问题.
如图是a、b、c三种固体物质的溶解度曲线图,根据曲线图回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化合物:青铜、硝酸钾 | B. | 混合物:矿泉水、石油 | ||
| C. | 碱:碳酸钠、氢氧化钠 | D. | 氧化物:过氧化氢、稀有气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将地沟油转化为航空油,变废为宝 | |
| B. | 使用新型的可降解塑料,减少白色污染 | |
| C. | 改进汽车尾气净化技术,减少有害气体排放 | |
| D. | 加高化工厂的烟囱排放废气,防止形成酸雨 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
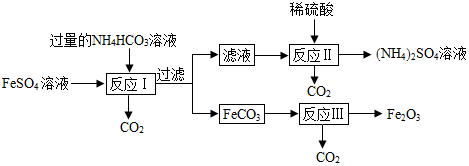
| A. | 反应Ⅰ需控制温度在35℃以下,原因可能是因为NH4H CO3受热易分解 | |
| B. | 滤液中的溶质只有( NH4)2 SO4 | |
| C. | 在空气中煅烧23.2g的FeCO3,得到Fe2O3和FeO的混合物15.2g.则生成Fe2O38.0g | |
| D. | 在空气中充分煅烧FeCO3,若煅烧时间越多,则最终所得固体的质量越小 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
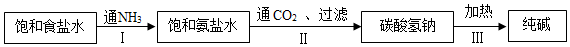
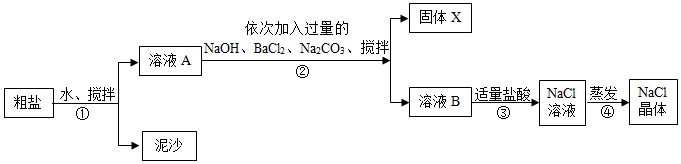
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com