
| A. | 镁带燃烧,发出耀眼白光,放出大量热,生成白色固体 | |
| B. | 铁钉与稀盐酸反应,银白色固体逐渐减少至消失,溶液由无色变成浅绿色 | |
| C. | 氢氧化钠溶液与氯化铁溶液混合,产生红褐色沉淀 | |
| D. | 甲烷燃烧产生明亮的蓝色火焰,放热 |
分析 A、根据镁带燃烧的现象进行分析判断.
B、根据金属的化学性质,进行分析判断.
C、根据碱的化学性质,进行分析判断.
D、根据甲烷燃烧的现象,进行分析判断.
解答 解:A、镁带燃烧,发出耀眼白光,放出大量热,生成一种白色固体,故选项说法正确.
B、铁钉是用钢制成的,主要成分是铁,含有碳等杂质,铁与稀盐酸反应,生成氯化亚铁和氢气,银白色固体逐渐减少,但不会全部消失,会得到黑色残渣,溶液由无色变成浅绿色,故选项说法错误.
C、氢氧化钠溶液与氯化铁溶液混合,产生红褐色沉淀,故选项说法正确.
D、甲烷燃烧,产生明亮的蓝色火焰,放出大量的热,故选项说法正确.
故选:B.
点评 本题难度不大,掌握碱的化学性质、金属的化学性质、常见物质燃烧的现象即可正确解答,在描述实验现象时,需要注意生成物的颜色、状态.


科目:初中化学 来源: 题型:选择题
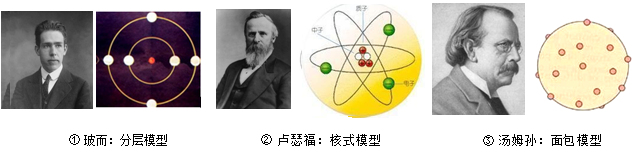
| A. | ①→②→③ | B. | ③→②→① | C. | ①→③→② | D. | ③→①→② |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 29.4% | C. | 24% | D. | 36.8% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
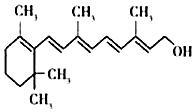
| A. | 维生素A属于有机高分子化合物 | B. | 维生素A中含有碳、氢、氧三种原子 | ||
| C. | 维生素A中氢元素的质量分数最大 | D. | 维生素A分子中含有51个原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 ’和“
’和“ ”代表两种不同的原子,下图是某化学反应的微观模拟图,请回答问题:
”代表两种不同的原子,下图是某化学反应的微观模拟图,请回答问题: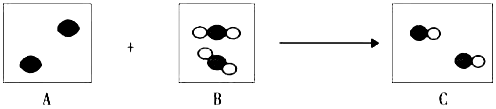
 (画粒子图).
(画粒子图).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 项目 | 限值 |
| 色度 | 不超过15度,并不得呈现其他异色 |
| 浑浊度 | 不超过1度,特殊情况下不超过5度 |
| pH | 6.5-8.5 |
| 总硬度(以CaCO3计) | 450mg/L |
| 铝 | 0.2mg/L |
| 铁 | 0.3mg/L |
| 硫酸盐 | 250mg/L |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
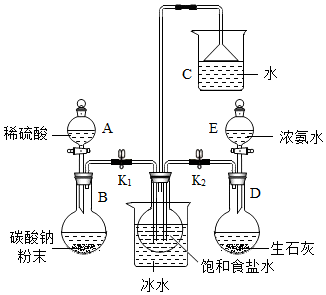
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com