
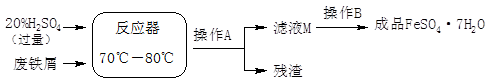
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
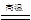 Fe2O3+ SO2↑+ SO3
Fe2O3+ SO2↑+ SO3  Fe2O3+ SO2↑+ SO3
Fe2O3+ SO2↑+ SO3 

科目:初中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.用水来鉴别食盐和硝酸铵 | B.用酚酞试液鉴别食盐水和稀硫酸 |
| C.用灼烧法鉴别棉花和羊毛 | D.用肥皂水鉴别硬水和软水 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
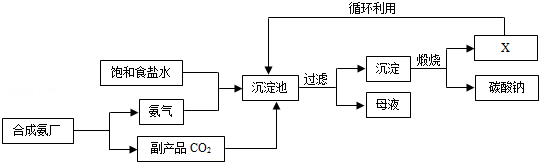
| A.沉淀池中的反应物共含有六种元素 |
| B.过滤得到的“母液”中一定只含有两种溶质 |
| C.图中X可能是氨气 |
| D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 |
查看答案和解析>>
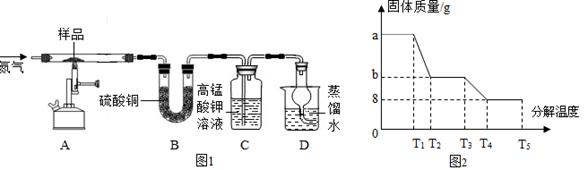
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加___________ | ___________ | 猜想①正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | “猜想一”不成立 |
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入Na2CO3溶液 | __________________ __________________ | “猜想一”成立 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.H+、Ba2+、OH- | B.Mg2+、Cl-、SO42- |
| C.Cu2+、Fe2+、OH- | D.NH4+、NO3-、OH- |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.在测定空气中氧气体积分数的实验中,用足量的铜粉除去氧气 |
| B.用澄清石灰水验证CO中混入的少量的CO2 |
| C.用过量的CaCl2溶液除去NaCl溶液中的少量杂质Na2CO3 |
| D.用稀盐酸检验暴露在空气中的NaOH固体是否变质 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题

| A.CuO | B.Fe | C.Ba(OH)2 | D.Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com