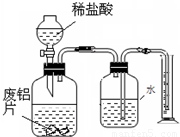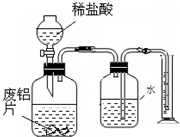
某兴趣小组为测定某废铝锅中铝变质的程度,从废铝锅底部剪一块16g的铝片,将它放入21.9%的稀盐酸中,小红通过称量剩余物质的质量求出氢气的质量,消耗盐酸的质量与剩余物质如下表所示(假设酸与氧化膜反应时没有H
2产生,其它杂质不与酸反应),请回答:
|
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
Ⅴ |
| 消耗盐酸质量(g) |
50 |
100 |
150 |
200 |
250 |
| 剩余物的总质量(g) |
66 |
115.7 |
165.4 |
215.1 |
264.8 |
(1)从表中看出,该反应产生了H
21.2
1.2
g,与氧化膜反应所消耗的酸的质量是
50
50
g.
(2)求被氧化的铝的质量占未氧化时铝片总质量的质量分数,写出具体计算过程.
(3)小芳通过如图所示装置测量氢气的体积来求未变质的铝的质量,通过小芳的方法测出被氧化的铝的质量
偏小
偏小
(填“偏大“、“偏小”或“准确”),请你说明理由
因为测量出氢气的体积包括了加入盐酸时所排出气体的体积使测得氢气的体积偏大,求出剩余铝的质量偏大,从而求出氧化铝的质量偏小,因此被氧化的铝的质量偏小
因为测量出氢气的体积包括了加入盐酸时所排出气体的体积使测得氢气的体积偏大,求出剩余铝的质量偏大,从而求出氧化铝的质量偏小,因此被氧化的铝的质量偏小
.

 某兴趣小组为测定某废铝锅中铝变质的程度,从废铝锅底部剪一块16g的铝片,将它放入21.9%的稀盐酸中,小红通过称量剩余物质的质量求出氢气的质量,消耗盐酸的质量与剩余物质如下表所示(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应),请回答:
某兴趣小组为测定某废铝锅中铝变质的程度,从废铝锅底部剪一块16g的铝片,将它放入21.9%的稀盐酸中,小红通过称量剩余物质的质量求出氢气的质量,消耗盐酸的质量与剩余物质如下表所示(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应),请回答:

 阅读快车系列答案
阅读快车系列答案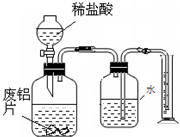 某兴趣小组为测定某废铝锅中铝变质的程度,从废铝锅底部剪一块16g的铝片,将它放入21.9%的稀盐酸中,小红通过称量剩余物质的质量求出氢气的质量,消耗盐酸的质量与剩余物质如下表所示(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应),请回答:
某兴趣小组为测定某废铝锅中铝变质的程度,从废铝锅底部剪一块16g的铝片,将它放入21.9%的稀盐酸中,小红通过称量剩余物质的质量求出氢气的质量,消耗盐酸的质量与剩余物质如下表所示(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应),请回答: