
分析 解答本题利用了盐的水溶性以及盐与盐之间的反应,本题中物质均溶于水,但是在水溶液中硫酸钠可以与氯化钡反应生成白色沉淀,该沉淀不溶于水且不溶于酸,碳酸钠也可以与氯化钡反应生成白色固体,但该白色固体能够溶于酸中,据此可以判断这两种白色的固体,由于氢氧化钙能与碳酸钠结合产生碳酸钙沉淀,碳酸钠存在,则氢氧化铜不存在;另外硫酸铜为白色物质,但是它的水溶液呈蓝色,据此也可以根据溶液是否有颜色来判断硫酸铜的有无,根据上述判断可以得出本题的解答.
解答 解:因该固体溶于水,可得到澄清的无色溶液,我们可判断一定不含硫酸铜,因硫酸铜溶液为蓝色.
又因向其中滴入氯化钡溶液,产生白色沉淀,再加入足量的稀硝酸,沉淀部分消失,可得混合物中一定含有硫酸钠和碳酸钠,由于氢氧化钙能与碳酸钠结合产生碳酸钙沉淀,碳酸钠存在,则氢氧化钙不存在;没有确定有还是没有的是氯化钠.
故填:Na2SO4、Na2CO3;CuSO4、Ca(OH)2.
点评 本题考查的是常见的物质的成分推断,完成此题,可以依据已有的知识进行.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:初中化学 来源: 题型:实验探究题
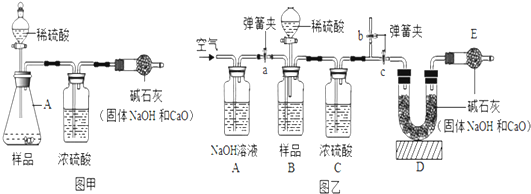
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 请你参与某校九年级(1)班化学研究性学习小组的探究活动,并回答相关问题.
请你参与某校九年级(1)班化学研究性学习小组的探究活动,并回答相关问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 甲、乙两同学在学完酸的化学性质后,做了如下实验:
甲、乙两同学在学完酸的化学性质后,做了如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
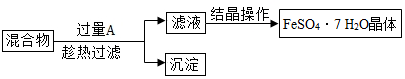
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com