
分析 (1)工业上用一氧化碳还原赤铁矿(主要成分是氧化铁)炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,进行分析解答.
(2)铁与水、氧气充分接触时容易生锈,使铁制品与氧气和水隔绝可以防止生锈.
解答 解:(1)工业上用一氧化碳还原赤铁矿(主要成分是氧化铁)炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)为了防止钢铁的锈蚀,人们常采用在其表面刷漆、涂油或镀上其他金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水.
故答案为:(1)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;(2)隔绝氧气和水.
点评 本题难度不大,掌握工业上用赤铁矿炼铁的反应原理、防止铁锈蚀的原理是正确解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 鉴别硬水和软水--肥皂水 | B. | 红磷燃烧前后质量的测定--气球 | ||
| C. | 二氧化碳的溶解性实验--软塑料瓶 | D. | 氯酸钾制取氧气--棉花 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 74.5g | B. | 10g | C. | 7.45g | D. | 29.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
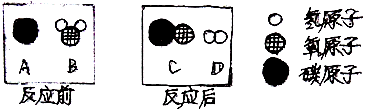
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com