
【题目】某校实验室有一包固体粉末可能由NH4Cl、Na2CO3、Ba(OH)2、BaCl2、Na2SO4中的一种或几种组成。为了确定其组成,某化学兴趣小组做了以下实验:
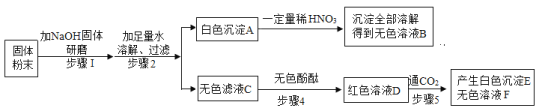
已知,步骤1中无明显现象;
请回答下列问题:
(1)这包固体中一定不存在的物质是_____;
(2)写出步骤2中产生白色沉淀A一定发生反应的化学方程式_____。
(3)步骤4所得红色溶液D中一定含有的溶质是_____。
(4)该实验小组实验结束后处理废液时,将无色溶液B、无色溶液F和沉淀E倒在了同一个废液缸里,发现沉淀消失并产生气泡,则废液缸中最终得到的废液中一定含有的溶质是_____。
【答案】NH4Cl、Na2SO4 Na2CO3+BaCl2=BaCO3↓+2NaCl、氢氧化钠、氯化钡 硝酸钡、氯化钠
【解析】
铵根离子和碱混合研磨会生成氨气,碳酸根离子和钡离子反应会生成溶于酸的碳酸钡沉淀,硫酸根离子和钡离子反应生成不溶于酸的硫酸钡沉淀,氢氧化钠能使酚酞变红色,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钡反应生成碳酸钡沉淀,所以:固体粉末中加入熟石灰研磨,没有明显现象,所以固体粉末中一定不含氯化铵,得到的白色沉淀全部溶解,所以样品中一定不含硫酸钡,一定含有碳酸钠,无色溶液C中滴加酚酞变红色,溶液D中通入二氧化碳,会生成白色沉淀,所以C中一定含有氢氧化钠、氯化钡。
由分析可知(1)这包固体中一定不存在的物质是NH4Cl、Na2SO4;
(2)步骤2中产生白色沉淀A一定发生的反应是碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为 Na2CO3+BaCl2=BaCO3↓+2NaCl。
(3)步骤4所得红色溶液D中一定含有的溶质是:氢氧化钠、氯化钡;
(4)该实验小组实验结束后处理废液时,将无色溶液B、无色溶液F和沉淀E倒在了同一个废液缸里,发现沉淀消失并产生气泡,则废液缸中最终得到的废液中一定含有的溶质是硝酸钡、氯化钠。


科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F、G八种物质,有如下图所示的反应关系,其中A是一种暗紫色固体,B、G都是黑色固体,D能使带火星的木条复燃,E、F是无色液体,H是一种能使澄清石灰水变浑浊发的气体。
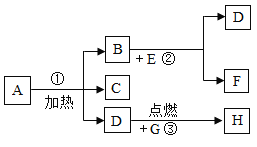
(1)试推断:A为__________;E为__________;H为__________。
(2)B在反应②中的作用是:_______________。
(3)写出反应①、③的反应表达式,并在括号里注明其反应类型。
①____________________________,_________
③____________________________,_________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】FeCl3溶液腐蚀铜、铁的反应分别为:Cu+2FeCl3=2FeCl2+CuCl2、Fe+2FeCl3=3FeCl2。从腐蚀过镀铜器件的废液中回收铜,并重新制得FeCl3的流程如下:
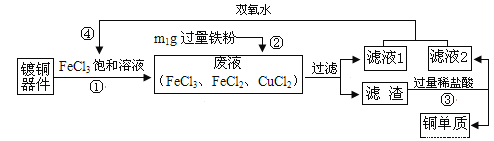
下列说法不正确的是( )
A.步骤②中发生化合反应与置换反应
B.“滤液1”中一定含FeCl2,可能含CuCl2,滤渣中一定含有铜可能含有铁
C.步骤④反应为:2M+2FeCl2+ H2O2=2FeCl3+2H2O,M是HCl
D.若滤渣也为m1g,则废液中FeCl3与CuCl2的质量比为65∶27
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某干燥剂含有CaO、NaOH和CaCl2中的两种物质。为了探究其成分,设计了如图所示实验。下列说法正确的是( )
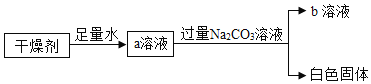
A.溶液a形成过程中一定只发生物理变化B.b溶液中一定有NaOH和Na2CO3
C.得到的白色固体一定不是纯净物D.干燥剂一定由 NaOH和CaCl2组成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学小组将等质量的锌、铁、铜三种金属粉末分别加入等质量、相同质量分数的稀硫酸中,观察到铜与稀硫酸无反应,测得锌、铁与稀硫酸反应产生气体体积与时间的关系如下图所示,关于该小组的实验有下列说法,其中正确的是( )
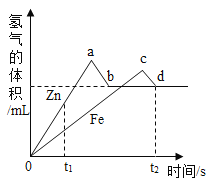
A.从t1时间就可以得出金属活动性:Zn>Fe>Cu
B.一定时间内气体体积从a降到b说明装置气密性不好
C.a>c是说明Zn生成的氢气比Fe多
D.反应结束后Fe一定剩余,Zn可能剩余
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学小组为探究铝、铜、银三种金属的活动性顺序,设计了下图所示实验方案(金属 丝使用时均已用砂纸打磨)。下列说法正确的是()
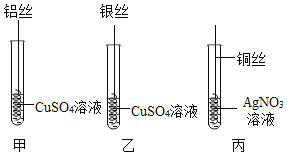
A.由实验甲可知金属活动性:Al>Cu
B.由实验乙可知金属活动性:Ag>Cu
C.实验甲中的CuSO4改为CuCl2,也能完成本实验探究
D.若要探究铝、铜、银活动性顺序,甲、乙、丙实验必须全做
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸亚铁铵((NH4)2SO4·FeSO4·6H2O)俗称摩尔盐,可用于净水和治疗缺铁性贫血。工业上常利用机械加工行业产生的废铁屑(含有少量杂质 Fe2O3)为原料制备(如图)。
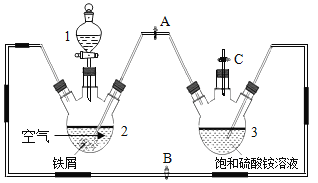
某化学兴趣小组拟用下列方案制备硫酸亚铁铵并进行相关探究。 查阅资料:
(1)FeSO4易被氧气氧化为Fe2(SO4)3,影响硫酸亚铁铵的等级。
(2)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体,该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(3)在0~60℃时,硫酸亚铁铵的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。
(探究一)用如上图所示装置制备硫酸亚铁铵。实验步骤如下:
①制备 FeSO4溶液:先关闭止水夹 A,再打开止水夹 B和 C,从分液漏斗滴加稀硫酸至三颈烧瓶2中,此装置中发生的化学反应主要有(用化学方程式表示)______、_______和![]() 。该过程中氢气的作用是______。
。该过程中氢气的作用是______。
②待装置中的铁屑快反应完时,关闭止水夹_______,打开止水夹_______,观察到的现象是_______。实验时为防止三颈烧瓶2中剩余铁屑通过导管进入三颈烧瓶3中,可采取的措施 是_______。
③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵晶体,从中获得硫酸亚铁铵晶体的主要实验操作为过滤、洗涤、干燥。为洗涤(NH4)2SO4·FeSO4·6H2O 粗产品,下列方法中最合适的是______。
A 用冷水洗 B 先用冷水洗,后用无水乙醇洗
C 用 30%的乙醇溶液洗 D 用 90%的乙醇溶液洗
(探究二)探究硫酸亚铁铵样品的纯度取5g硫酸亚铁铵晶体溶于50mL水配成溶液,等分成两份,分别进行实验。
方案一:![]()
(1)实验中加入过量BaCl2溶液的目的______。
(2)利用方案一测得的数据,计算该硫酸亚铁铵样品的纯度(列出具体计算步骤)。((NH4)2SO4·FeSO4·6H2O的相对分子质量:392)__________
方案二:如图所示,向另一份中加入过量的NaOH溶液,充分反应后得到NH3
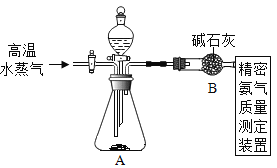
(3)(NH4)2SO4与NaOH反应的化学方程式为_______。
(4)实验中需不断通入高温水蒸气,其作用是_______。
(5)在实际测量中,利用方案二测得的样品纯度总是低于方案一测得的数值,可能的原因是______。
(探究三)对硫酸亚铁铵((NH4)2SO4·FeSO4·6H2O)晶体进行热重分析,温度与TG%的关系如下图所示
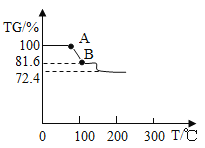
已知:温度低于 200℃,只有结晶水失去。
已知:TG% =![]()
TG%从 100%降低为 72.4%时,发生反应的化学方程式是_______ 。试计算AB段物质的化学式______________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某合金由铜与锌组成。现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为19.6%的稀硫酸平均分四份依次加入该烧杯中,每次均充分反应。实验数据如下:
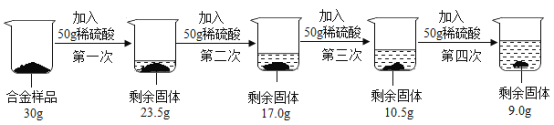
请计算:
(1)该合金中铜的质量为______________________g。
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数__________________(写出简明计算过程,结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学来源于生活,应用于生活。据化学知识回答下列问题:
(1)某些食品包装袋内常用铁粉作“双吸剂”,以防止食品腐败,其主要作用是吸收空气中的_________。
(2)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他
还需要的另外两种溶液是______、______。
(3)洗洁精能清除油污,这是利用它的___________作用。液态的植物油和固态的动物脂肪合称为油脂,若锅里的油着火了,可采取的灭火措施是______________。
(4)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:
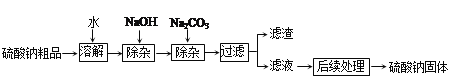
回答下列问题:
溶解过程需要的玻璃仪器有烧杯和____________。
用NaOH除杂时,反应的化学方程式为___________________________。
③ NaOH和Na2CO3如果添加过量了,可加入适量_______________溶液除去。
④“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至_____(填序号)。A. 完全蒸干时停止加热 B. 有较多固体析出时停止加热,利用余热蒸干 C. 有大量固体析出时停止加热,过滤弃去剩余的少量溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com