
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
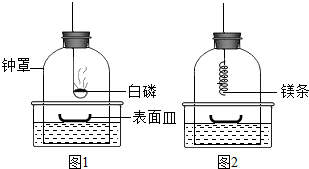
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
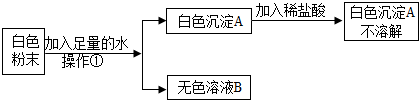
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化碳过多引发酸雨 | B. | 二氧化碳气体可用于人工降雨 | ||
| C. | 二氧化碳可使紫色石蕊试液变蓝 | D. | 二氧化碳可作为气体肥料 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
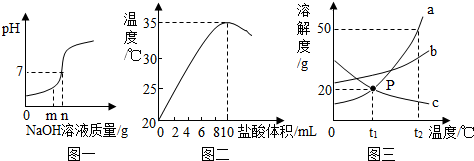
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 每个阿司匹林分子中含3 个氢分子 | |
| B. | 它的相对分子质量为138 g | |
| C. | 该化合物中碳、氢、氧三种元素质量比为12:l:16 | |
| D. | 69 g 阿司匹林含碳元素质量为42 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com