
| ||
| 160 |
| x |
| 48 |
| 18.8g-14g |
| 2.8g |
| 14g |
| 18 |
| 16 |
| ||
| 160 |
| x |
| 54 |
| 5.4g |
| 2.8g |
| 14g |
| 160 |
| 48 |
| 2.8g |
| 14g |


科目:初中化学 来源: 题型:
| A、天然气属一级能源 |
| B、煤属二级能源 |
| C、家用电器使用的电能属一级能源 |
| D、风能属二级能源 |
查看答案和解析>>
科目:初中化学 来源: 题型:
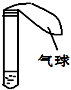 如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,能观察到气球变大的一组物质是( )
如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,能观察到气球变大的一组物质是( )| A、氯化钠和水 |
| B、铜粉和稀硫酸 |
| C、硝酸铵和水 |
| D、氢氧化钠和水 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、H2O,H2SO4,NaOH |
| B、Ca(OH)2,H2O,HCl |
| C、H2SO4,H2O,NaOH |
| D、HCl,CaO,H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:
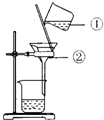 如图所示:
如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:
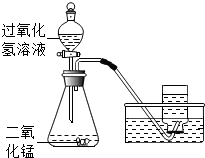 如图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表.
如图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表.| 气体发生装置内物质的总质量 | |
| 反应前 | 35.6 |
| 反应后 | 34.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com