15.草酸的化学式为H
2C
2O
4,甲、乙两同学对草酸受热分解及其产物的检验做了探究:
【猜想与假设】猜想一:分解产物是 CO
2、H
2O 猜想二:分解产物是CO、H
2O
猜想三:分解产物是CO
2、CO 猜想四:分解产物是CO
2、CO和H
2O
以上猜想中,不可能的是猜想三,原因是根据质量守恒定律化学反应前后元素种类不变.
【查阅资料】
(1)无水硫酸铜遇水由白色变成蓝色
(2)碱石灰(CaO和NaOH的混合物)是一种常用的干燥剂
(3)草酸晶体熔点较低,加热到182℃即可以熔化成液体
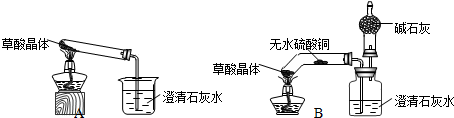
【实验设计】甲同学设计了A装置,乙同学设计了B装置.
(注:①图中铁架台略去 ②B中所用容器为底部弯曲的试管)
【实验过程】
(1)甲同学按A装置实验.在给草酸晶体加热时,先均匀加热,然后固定在试管底部加热,过一会儿观察到澄清石灰水变浑浊.
(2)乙同学按B装置实验.观察到无水硫酸铜由白色变成蓝色,澄清的石灰水变浑浊,且生成的气体通过碱石灰后,在干燥管的尖嘴处点燃,该气体能燃烧.通过进一步检验,燃烧的气体为CO.乙同学验证燃烧气体为CO的实验操作与现象是在火焰上方罩一个内壁用澄清的石灰水润湿的小烧杯,澄清的石灰水变浑浊;.
【实验结论】猜想四是正确的,请写出草酸受热分解的化学方程式H
2C
2O
4$\frac{\underline{\;\;△\;\;}}{\;}$CO
2↑+CO↑+H
2O.
【反思与评价】
经过实验和讨论,同学们认为乙同学的设计是比较科学合理的.请你对比两套装置,指出B装置的两条优点是可以同时证明CO
2、CO、H
2O的存在;在验证了CO存在的同时又解决了CO的污染问题等.

 阅读快车系列答案
阅读快车系列答案