

分析 (1)根据实验室常用仪器解答;
(2)据加热固体的注意事项分析解答;
(3)装置B适用于固体和液体常温反应制取气体,实验室利用过氧化氢制取氧气不需加热,可用此装置;实验时产生气体速度太快,可能是反应物的浓度过大或滴加的速度过快;并据排水法收集气体回答;
(4)氯化铵受热分解可以制得氨气和氯化氢气体,会导致收集的氨气不纯.
解答 解:(1)根据实验室常用仪器可知:①酒精灯;②锥形瓶;
(2)给试管内固体加热时试管口应向下倾斜,防止冷凝水倒流引起试管炸裂,且伸入试管内的导管稍微露出塞子即可,太长不利于气体的导出;
(3)装置B适用于固体和液体常温反应制取气体,实验室利用过氧化氢制取氧气不需加热,可用此装置,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.实验时产生气体速度太快,可能是反应物的浓度过大或滴加的速度过快,所以可调节活塞,减缓液体滴加速度或者向分液漏斗中加水使反应物的浓度降低;利用排水法收集气体时若导管口有气泡冒出,说明收集满了;
(4)氯化铵受热分解可以制得氨气和氯化氢气体,会导致收集的氨气不纯,所以小刚的选择不合理;
故答案为:
(1)①酒精灯;②锥形瓶;
(2)试管口应该略向下倾斜; 伸入试管内导管应稍微露出橡皮塞即可;
(3)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑; 调节活塞,减缓液体滴加速度或者向分液漏斗中加水; 集气瓶口有大气泡冒出;
(4)不合理; 因为产生氨气和氯化氢两种气体,不可能得到纯净的氨气.
点评 本题考查实验装置的选取,化学方程式的书写,考查知识点较多,但难度不大,只要对课本中的基础知识掌握了,就能做好此题.根据装置特点可以判断装置图的正误,根据操作要求可以判断操作是否符合实验室的规定;氧气的验满将带火星的木条放在集气瓶口


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
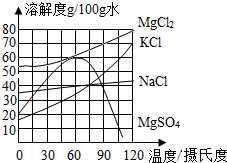 食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富,通过晾晒海水可以得到粗盐和卤水.如图所示为NaCl及卤水主要成分的溶解度曲线图.
食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富,通过晾晒海水可以得到粗盐和卤水.如图所示为NaCl及卤水主要成分的溶解度曲线图.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 茶氨酸属于有机高分子化合物 | |
| B. | 一个茶氨酸分子中含有一个氮分子 | |
| C. | 茶氨酸中氧元素的质量分数最大 | |
| D. | 茶氨酸中碳元素与氢元素的质量比为6:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
| 名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 活氧彩漂 | 污渍爆炸盐 |
| 产品样式 |  |  |  |  |  |
| 有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过氧化氢 | 过碳酸钠 |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 偏向左边 | B. | 偏向右边 | C. | 仍指零处 | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 煤油 | 丙醇 | 四氯化碳 | 乙醚 |
| 沸点/℃ | 180-310 | 97.4 | 76.5 | 34.5 |
| A. | 煤油 | B. | 丙醇 | C. | 四氯化碳 | D. | 乙醚 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
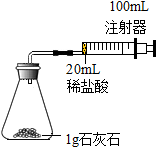 某化学实验小组对“影响石灰石与盐酸反应速率的因素--盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与.
某化学实验小组对“影响石灰石与盐酸反应速率的因素--盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与.| 实验编号 | 盐酸溶质质量分数 (均取20mL) | 石灰石固体形状 (均取1g) | 二氧化碳体积(mL) (均收集前30S的气体) |
| a | 4% | 颗粒 | 64.0 |
| b | 4% | 块状 | 40.4 |
| c | 6% | 颗粒 | 98.2 |
| d | 6% | 块状 | 65.3 |
| 时间/S | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
| 气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com