
��2005?�����У�ijѧУ����С�飬�Ա��ػ������ŷŷ�ˮ�е����Ậ�������˲ⶨ��ȡ��ˮ50g����2%������������Һ�����кͣ�����ҺpH=7ʱ����ȥ����������Һ20g�������ˮ���������������������
�ⶨʱ����ͬѧ�����ڷ�Ӧ�����У���Һ���¶ȵı仯���������ǽ�һ��������̽����
��1������100mL10%�����ᣨ�ܶ�Ϊ1.05g/cm
3��������Ӧ��ȡ38%�����ᣨ�ܶ�Ϊ1.19g/cm
3�����ٺ�����
��2����һ�������10%������������Һ�У����������������Ƶ�10%�����ᣮ�й�ʵ���е����ݼ�¼���£�
| ��������������V��/mL |
2 |
4 |
6 |
8 |
10 |
| ��Һ�¶ȱ仯����t��/�� |
5.2 |
9.6 |
13.0 |
16.0 |
18.2 |
������ͼ����ϵ�л����Һ�¶ȱ仯������������֮��ı仯��ϵͼ��
��3�����ݣ�2���й�ϵͼ������������仯�ĽǶ�̸̸���кͷ�Ӧ����ʶ��

 ��2005?�����У�ijѧУ����С�飬�Ա��ػ������ŷŷ�ˮ�е����Ậ�������˲ⶨ��ȡ��ˮ50g����2%������������Һ�����кͣ�����ҺpH=7ʱ����ȥ����������Һ20g�������ˮ���������������������
��2005?�����У�ijѧУ����С�飬�Ա��ػ������ŷŷ�ˮ�е����Ậ�������˲ⶨ��ȡ��ˮ50g����2%������������Һ�����кͣ�����ҺpH=7ʱ����ȥ����������Һ20g�������ˮ���������������������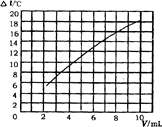



 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
 ��2005?�����У�����ѧϰС���ͬѧ��������鱗�Ʒ��װ���ϵ�˵������ͼ�����Բ�Ʒ�ĺ��������������ʣ�����������ѧ��֪ʶ������淋ĺ����������˼��㣬����Ϊ��װ���ϱ�ע�ĺ�������ȷ��С�����ͬѧ�ļ���������£�
��2005?�����У�����ѧϰС���ͬѧ��������鱗�Ʒ��װ���ϵ�˵������ͼ�����Բ�Ʒ�ĺ��������������ʣ�����������ѧ��֪ʶ������淋ĺ����������˼��㣬����Ϊ��װ���ϱ�ע�ĺ�������ȷ��С�����ͬѧ�ļ���������£�