
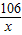 =
=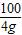 x=4.24g
x=4.24g ×100%=14.1%
×100%=14.1%

科目:初中化学 来源: 题型:
 28、实验室中有一瓶无色液体,经测定其中只含氢、氧两种元素.请你对该无色液体进行如下探究活动,请回答下列问题:
28、实验室中有一瓶无色液体,经测定其中只含氢、氧两种元素.请你对该无色液体进行如下探究活动,请回答下列问题:| 实验步骤 | 实验现象 | 实验结论 |
| 取少量无色液体,加入盛有少量黑色二氧化锰的试管中 | 若有气泡 若无气泡 |
该液体是H2O2 该液体是H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:
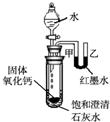
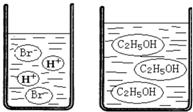
查看答案和解析>>
科目:初中化学 来源: 题型:
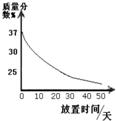
 实验室有一瓶氢氧化钾浓溶液,瓶上标签内容如图所示,请你根据签上提供的数据解答下列问题:
实验室有一瓶氢氧化钾浓溶液,瓶上标签内容如图所示,请你根据签上提供的数据解答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
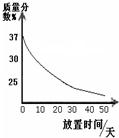
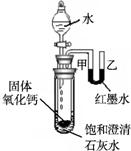

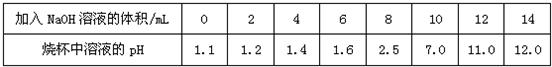
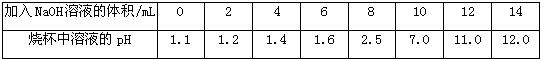
查看答案和解析>>
科目:初中化学 来源:北京模拟题 题型:填空题
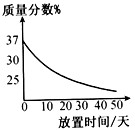
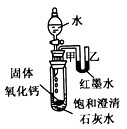
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com