
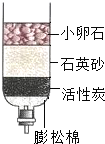
 (1)天然水中含有的部分杂质如表所示:
(1)天然水中含有的部分杂质如表所示:| 溶 解 物 质 | 悬浮物质 | ||
| 主要气体 | 主要离子 | 生物生成物 | 细菌、藻类及原生 物、泥沙、黏土等 |
| 氧气 二氧化碳 硫化氢等 | 钙离子、氯离子、 硫酸根离子、镁离子 | NH4+、NO2-、 HPO42-、Fe3+、 H2PO4-等 | |
分析 (1)①根据氧气和二氧化碳的组成写化学式.
②根据离子符号的写法解答.
③根据组成磷酸二氢铵的离子写化学式.
(2)根据活性炭吸附可以出去色素和异味解答;
(3)①根据明矾能够吸附水中的悬浮物氯水能够消毒杀菌进行解答;
②根据在化合物中正负化合价代数和为零,结合硫酸铝钾的化学式进行解答即可;
③根据沉淀、过滤不能除去水中可溶性杂质进行解答.
解答 解:(1)①氧气是双原子分子,每个分子由两个原子组成,氧的元素符号为O.二氧化碳是三原子分子,每个分子由一个碳原子和两个氧原子构成.故答案为:O2,CO2.硫化氢中氢元素的化合价为+1价;
②钙的元素符号是Ga,钙离子带两个单位正电荷,符号为:Ca2+;硫酸根离子的符号为:${SO}_{4}^{2-}$;
③磷酸二氢铵是由铵根离子和磷酸二氢根离子组成的,故答案为:NH4H2PO4.
(2)活性炭吸附可以出去色素和异味,起吸附作用;此过程没有新物质生成,属于物理变化;
(3)①明矾能够吸附水中的悬浮物,可以除去较大颗粒、悬浮物杂质的步骤是A;氯水能够消毒杀菌,能够消毒杀菌的步骤为D;
②钾元素显+1价,铝元素显+3价,氧元素显-2价,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+(+3)+2x+(-2)×4×2=0,则x=+6价;
③沉淀、过滤不能除去水中可溶性杂质,生产得到的净水是混合物.
答案:
(1)①O2,CO2;+1;②Ca2+;${SO}_{4}^{2-}$;③NH4H2PO4.
(2)活性炭;物理;
(3)①A;D;②+6;③混合物;净水中还含有其它可溶性物质.
点评 本题主要考查了离子符号和化学式的书写,也考查了过滤和吸附的应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:多选题
| A. | 地壳中金属元素的含量 | B. | 金属活动性顺序 | ||
| C. | 金属冶炼的难易程度 | D. | 金属的导电性 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 设计目的 |
| 将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油. | 隔绝空气证明红色消失与氧气和二氧化碳无关 |
| 实验方法 | 可能观察到的现象 | 相应结果或结论 |
| 取两支试管,分别加入相同质量的氢氧化镁和热水,振荡,然后各滴加数滴酚酞溶液.一支保持温度不变,另一支自然冷却 | 保持温度不变的红色不消失,自然冷却的红色消失 | 红色消失与氢氧化镁的溶解度随温度降低而减小有关 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Cu、Ag | B. | Zn、Fe | C. | Pt、Cu | D. | Ag、Au |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 金属 | Ti | Mg | Ag |
| 反应现象 | 反应缓慢 | 反应强烈 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com