
如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是 ( )
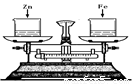
A.向左偏 B.向右偏
C.先向右偏后向左 D.先向左偏后向右偏
C
【解析】
试题分析:锌的金属活动性强于铁,锌和盐酸反应的速率快与铁,故刚开始时,天平指针先向右偏,但相同质量的锌和铁与足量的盐酸反应,铁置换的氢气较多,故反应结束后,天平指针偏向左。选C。
考点:金属活动性。
点评:金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。
在金属活动性顺序中,氢前的金属能与酸发生置换反应,且位置越靠前,反应越剧烈;位置在前的金属能把位于其后的金属从其盐溶液中置换出来。
反应后生成物质金属都是+2价的情况下,相同质量的金属与足量酸反应,相对原子质量越小的金属,反应产生的氢气越多。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解

| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |

| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com