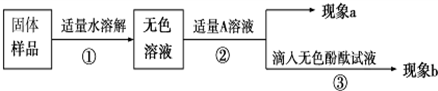
某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,并进行中和反应的有关实验.请你与他们一起完成以下探究活动:
[对固体猜想]
猜想I:全部是Na
2CO
3,猜想的依据是
CO2+2NaOH=Na2CO3+H2O(或空气中的CO2与NaOH反应生成Na2CO3)
CO2+2NaOH=Na2CO3+H2O(或空气中的CO2与NaOH反应生成Na2CO3)
;
猜想Ⅱ:全部是NaOH
猜想Ⅲ:部分是NaOH,部分是Na
2CO
3.
[实验和推断]
(1)若现象A为有气泡产生,则加入的X溶液是
稀盐酸(或稀硫酸等)
稀盐酸(或稀硫酸等)
,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是
Na2CO3+2HCl=2NaCl+H2O+CO2↑(与所选的酸对应,合理均可)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(与所选的酸对应,合理均可)
.
(2)若X是Ca(OH)
2溶液,现象A有白色沉淀,现象B为无色酚酞试液变红色,则白色沉淀为
CaCO3
CaCO3
(填化学式),该实验
不能
不能
(填“能”或“不能”)说明样品中有NaOH.
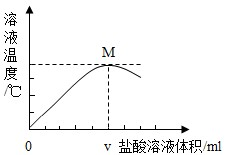
(3)如图是向净化后的氢氧化钠溶液中逐滴加入盐酸时溶液温度与盐酸溶液体积之间的变化关系图.图中M点的意义是
氢氧化钠和盐酸恰好完全反应
氢氧化钠和盐酸恰好完全反应
,此时反应中氢氧化钠和氯化氢的质量比是
80:73
80:73
,氢氧化钠和盐酸的反应是
放热
放热
反应(填“放热”或“吸热”).当所加盐酸的体积大于v mL时,溶液中存在的溶质是
NaCl、HCl
NaCl、HCl
.
(4)为从定量角度认识中和反应,小明同学自行设计并进行了下面实验:
①在小烧杯中倒入8%的氢氧化钠溶液l0g,滴入2滴酚酞试剂后,溶液呈红色;
②另取10%的稀盐酸逐滴滴加到氢氧化钠溶液中,边滴边振荡,随盐酸滴入,溶液颜色逐渐变浅;
③在溶液红色消失瞬间,停止实验.
若停止实验时,两溶液恰好反应.请分析小明实验后回答:实验中酚酞试剂的作用是
判断反应进行和进行的程度
判断反应进行和进行的程度
;计算出这时所得溶液的溶质质量分数是多少?(精确到0.1%)



 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
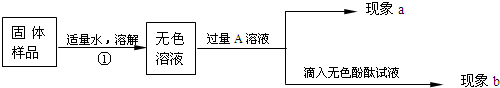
 某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,并进行中和反应的有关实验.请你与他们一起完成以下探究活动:
某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,并进行中和反应的有关实验.请你与他们一起完成以下探究活动: