
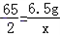 ,
,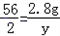 ,
,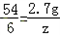
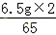 =0.2g,y=
=0.2g,y= =0.1g,z=
=0.1g,z=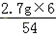 =0.3g,
=0.3g, 所以r=
所以r=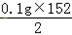 =7.6g.
=7.6g.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:新教材完全解读 九年级化学 (上册) 人教版 人教版 题型:038
某一含铜6.4 g、锌6.5 g、铁5.6 g、铝2.7 g的金属粉末混合物,与一定质量的稀硫酸反应.待反应停止后,经实验测得尚有9.2 g固体没有反应掉,通过计算回答:
(1)可得到氢气多少升?(已知该条件下2 g氢气占体积22.4 L)
(2)生成硫酸亚铁多少克?
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com