在托盘天平两端的烧杯中,分别盛有等质量、等质量分数的稀硫酸,天平平衡.然后向两只烧杯中分别加入一定量的Mg和Mg(OH)2,两烧杯中的物质均恰好完全反应后,将游码移到1.8g处,天平重新平衡.则天平右盘中加入的物质及其质量为下列的( )
A.Mg 21.6g
B.Mg 1.2g
C.Mg(OH)22.9g
D.Mg(OH)221.6g
【答案】
分析:此题将物质与酸反应引起的质量变化以及天平平衡相结合.天平平衡本身就隐含着质量等量变化关系,即.由题意知,稀硫酸恰好与Mg和完全反应,反应的化学方程式分别为,.由上述化学方程式和题意可知:的质量相等且足量,则生成的质量相等,参加反应的Mg、Mg(OH)
2中镁元素的质量相等.再根据“左物右码”的原理推测右盘所放物质种类.
解答:解:因为左右两旁中放的硫酸质量和质量分数都相等,且分别加入一定量的Mg和Mg(OH)
2后,两烧杯中的物质均恰好完全反应,
设所加硫酸质量为m,Mg(OH)
2质量为x,Mg 质量为y,生成氢气质量为z,则
H
2SO
4+Mg(OH)
2=MgSO
4+2H
2O H
2SO
4+Mg=MgSO
4+H
2↑
98 58 98 24 2
m x m y z
解得 x=

y=

z=
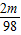
可见要使硫酸反应完全所加Mg的质量少,另外它还会放出氢气,再结合反应结束后还需将游码移到1.8g处,天平才会重新平衡,说明右盘质量少,所以Mg应该放在右盘.
根据m
物体=m
砝码+m
游码所以
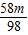
=
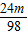
-

+1.8
解得m=4.9
所以Mg的质量y=

=1.2g
故答案为B
点评:此题左盘中物质的总质量=硫酸质量+Mg(OH)
2质量,右盘中物质总质量=硫酸质量+Mg的质量-放出H
2质量.

 y=
y= z=
z=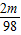
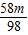 =
=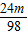 -
- +1.8
+1.8 =1.2g
=1.2g

 阅读快车系列答案
阅读快车系列答案