
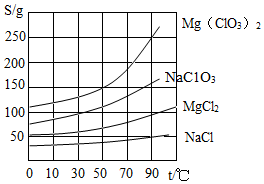
 如图是几种物质的溶解度曲线图,下列有关说法中正确的是 ( )
如图是几种物质的溶解度曲线图,下列有关说法中正确的是 ( )| A. | NaCl的溶解度是50克 | |
| B. | 50℃时四种物质形成的饱和溶液中MgCl2溶液的质量分数最小 | |
| C. | 将等质量的四份饱和溶液由90℃降温至50℃,析出晶体最多的是Mg(ClO3)2 | |
| D. | 将NaC1O3和MgCl2两种饱和溶液混合后无晶体析出.在加热蒸发时开始有晶体析出.此晶体是NaClO3 |
分析 A、据溶解度曲线可知某温度下物质的溶解度大小;
B、饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%;
C、等质量饱和溶液降低相同的温度,溶解度变化大的析出晶体多;
D、利用电离理论结合溶液中的离子情况,分析会出现的物质,并对不同物质的溶解度受温度的影响的不同解答.
解答 解:A、不知温度,无法判断氯化钠的溶解度,故错误;
B、50℃时四种物质的溶解度氯化钠的最小,据饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%可知:溶解度小则溶质的质量分数小,所以形成的饱和溶液中NaCl溶液的质量分数最小,故错误;
C、将等质量的四份饱和溶液由90℃降温至50℃,析出晶体最多的是Mg(ClO3)2,因为其溶解度变化最大,正确;
D、NaC1O3和MgCl2两种饱和溶液中含有镁离子、钠离子两种阳离子,有C1O3-和Cl-两种阴离子,可能出现氯酸钠、氯化镁、氯酸镁、氯化钠四种物质,对混合液进行蒸发,此时温度较高,而在高温时NaCl的溶解最小,故溶液中的Na+、Cl-将首先结合为NaCl析出,故错误;
故选:C.
点评 做好该题的关键是了解溶解度曲线的意义并注意图形结合,利用好溶解度和溶解度曲线及二者的关系,并结合题意细心分析解答即可.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 空气是一种宝贵的自然资源 | |
| B. | 空气中氮气约占空气总体积的五分之一 | |
| C. | 空气中的稀有气体不与任何气体发生反应 | |
| D. | 汽车排放的尾气不会对空气造成污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 正确使用化学仪器和进行化学实验基本操作是做好化学实验的重要前提.
正确使用化学仪器和进行化学实验基本操作是做好化学实验的重要前提.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质的水溶液一定是无色透明的 | |
| B. | 饱和溶液是纯净物,不饱和溶液是混合物 | |
| C. | 当饱和溶液的温度升高时,其溶质的溶解度一定变大 | |
| D. | 饱和溶液不一定比不饱和溶液中溶质的质量分数大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com