
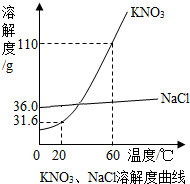
 KNO3、NaCl溶液在生产、生活中起着十分重要的作用.如图是它们的溶解度曲线,下表是它们在不同温度时的溶解度.
KNO3、NaCl溶液在生产、生活中起着十分重要的作用.如图是它们的溶解度曲线,下表是它们在不同温度时的溶解度.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.8 |




 优等生题库系列答案
优等生题库系列答案科目:初中化学 来源: 题型:
 25、如图是几种固体物质的溶解度曲线.请根据图回答下列问题:
25、如图是几种固体物质的溶解度曲线.请根据图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 25、右图为NaNO3、KNO3、NaCl、和KCl 的溶解度曲线.请回答下面提出的问题:
25、右图为NaNO3、KNO3、NaCl、和KCl 的溶解度曲线.请回答下面提出的问题:查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 溶解度 /g |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
| KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com