4.
在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠.
用化学方程式表示固体中有碳酸钠的原因:2NaOH+CO
2═Na
2CO
3+H
2O.
【查阅资料】
Na
2CO
3溶液pH>7,BaCl
2溶液pH=7,Na
2CO
3+BaCl
2=BaCO
3↓+2NaCl
【进行实验】
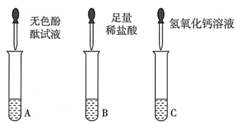
从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如下实验.
【实验分析】
甲、乙、丙同学分别得出如下的结论:
甲同学:向B试管的溶液中滴加足量的稀盐酸,产生大量无色气体,则固体为Na
2CO
3,B试管中现象产生的原因是Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑(用化学方程式表示).
乙同学:向A试管的溶液中加入几滴无色酚酞试液,溶液变红,则固体中一定含有NaOH.
丙同学:向溶液中加入Ca(OH)
2溶液,有白色沉淀产生,再向上层清液中滴加无色酚酞试液,溶液变红色,则固体为NaOH和Na
2CO
3.
【反思与评价】
丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做了正确的判断.
他认为固体中一定含有Na
2CO
3,可能含有NaOH.
为进一步确认猜想二正确,请你帮助他设计实验进行验证.
【实验反思】
(1)试剂瓶中的固体结块的原因可能是氢氧化钠吸水潮解.
(2)在溶解固体时放出了一定的热量,依据此现象有同学认为该固体中一定有氢氧化钠,为验证该同学的结论是否正确,还应该进行的实验是取碳酸钠固体将其溶解,观察是否有放热现象.
(3)二氧化碳气体通入到氢氧化钠溶液中,戊同学说可以证明二者发生了反应,你同意(选填“同意”或“不同意”)戊同学的观点,理由是二氧化碳的体积会减少.
【实验反思】
戊同学又用下图所示装置进行实验来探究二氧化碳是否与氢氧化钠溶液反应.
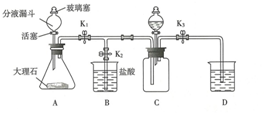
(1)收集一瓶二氧化碳:打开止水夹K
1和K
3,关闭K
2,从分液漏斗向装置A中加入足量的稀盐酸,写出A中发生反应的化学方程式:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑.
当看到D中有大量浑浊产生时,CO
2已集满,写出D中发生的化学方程式:CO
2+Ca(OH)
2=CaCO
3↓+H
2O;
(2)证明二氧化碳与氢氧化钠发生了化学反应:
关闭止水夹K
1和K
3,打开止水夹K
2,从分液漏斗C中加入适量滴有酚酞的氢氧化钠溶液,直至实验结束,请写出C中发生反应的化学方程式:2NaOH+CO
2=Na
2CO
3+H
2O;Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑.C中观察到的现象中,能证明CO
2与NaOH确实发生了化学反应的是C中有气泡产生.



 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案 在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.
在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.