
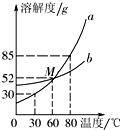
右图为某一固体物质的溶解度曲线,在20℃时,将40g该物质加入到100g水中,有关叙
述正确的是
A.该溶液为饱和溶液
B.若降温到10℃,溶液质量不变
C.若升温到40℃,溶质质量分数减小
D.若升温到50℃,溶质质量分数计算式为: 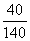 ×100%
×100%
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
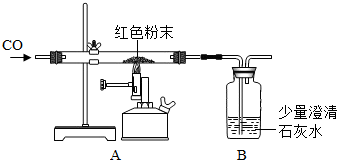 (2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:| 反应前 | 反应后 | |
| Ⅰ组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0g | 洗气瓶和瓶中物质的总质量为183.1g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. | 试管中有大量的气泡产生,伸入的带火星的木条复燃 |
FeCl3溶液可以催化分解H2O2 |
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管 | 无明显现象 | 起催化作用的不是Cl- |
| 向盛有5ml5%的H2O2溶液的试管中加入少量的 Fe(NO3)3溶液 ,并把带火星的木条伸入试管 |
试管中有大量气泡产生,带火星的木条复燃 |
起催化作用的是Fe3+ |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2009?通州区一模)(1)溶液在生产生活中有许多重要应用,在医疗上常用的消毒杀菌剂碘酒溶液中,溶质是
(2009?通州区一模)(1)溶液在生产生活中有许多重要应用,在医疗上常用的消毒杀菌剂碘酒溶液中,溶质是查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.| 阴离子 阳离子 |
OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的 BaCl2 BaCl2 溶液,充分反应后过滤 |
有白色沉淀生成 | 有关反应的化学方程式为 Na2CO3+BaCl2═BaCO3↓+2NaCl Na2CO3+BaCl2═BaCO3↓+2NaCl |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 滤液变为红色 滤液变为红色 |
该样品中含有氢氧化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com