
【题目】下列图示,不能正确反映化学反应原理的是( )
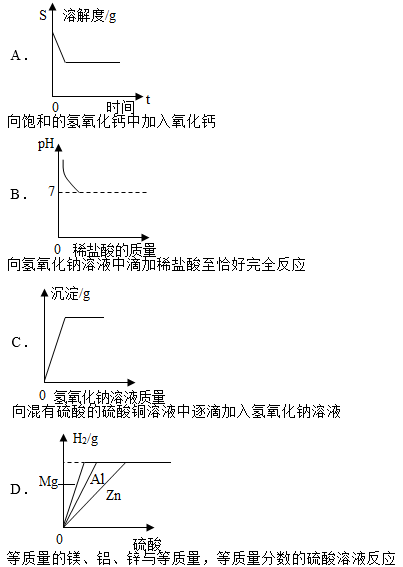
【答案】C
【解析】
试题分析:解答图像类的题目抓住“三点一走势”,即首先看清楚横、纵坐标各表示的量,然后从起始点、转折点、终点还有量的变化趋势来进行分析解答,A、向饱和氢氧化钙溶液中加入氧化钙固体,由于氧化钙固体会与水反应会放出热量使温度升高,氢氧化钙的溶解度降低,正确,B、向氢氧化钠溶液中不断加入稀盐酸,发生中和反应,故PH不断减少直至恰好中和,pH=7,正确,C、混有硫酸的硫酸铜溶液中加入氢氧化钠溶液,先后发生2个反应:2NaOH+H2SO4=Na2SO4+2H2O,CuSO4+2NaOH==Cu(OH)2↓+Na2SO4,故刚开始加入氢氧化钠溶液应没有沉淀生成,错误,D、分别向等质量的镁、铝、锌中加入溶质质量分数相同的稀硫酸,由于金属的活动性:镁>铝>锌,故相同时间内的氢气质量镁>铝>锌,,正确,故选C


科目:初中化学 来源: 题型:
【题目】为探究Fe、Cu、Ag的金属活动性强弱,某兴趣小组做了如下实验:
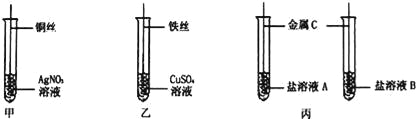
(1)实验前需将金属丝打磨,目的是 .
(2)甲实验中发生反应的化学方程式为 ;乙实验中观察到的现象为 .
(3)通过甲、乙实验探究,可得出三种金属活动性由强到弱的顺序为 .
(4)若采用丙实验方案也可得出相同结论,则金属C是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动.
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】小敏的猜想是Al>Cu>M;小强的猜想是Al>M>Cu;你的猜想是 。
【设计与实验一】小莉取M丝、铜丝、铝丝和编号为①、②、③的3支试管,进行如表的实验(试管中均盛有体积相同、溶质质量分数也相同的稀盐酸);
实验操作 | M丝插入试管①中 | 钢丝插入试管②中 | 铝丝插入试管③中 | 实验结论 |
刚开始的现象 | 有少量气泡产生 | 无气泡 | 无气泡 | M>Cu: |
几分钟后的现象 | 有少量气泡产生 | 无气泡 | 有大量气泡产生 |
|
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是 。
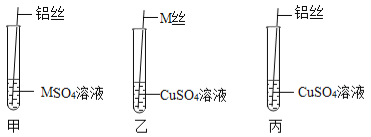
【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取粗细相同,打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验:
(1)试管乙中观察到的现象是 。
(2)试管丙中反应的化学方程式为 。
【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管 (填试管编号)中的实验,也可以得出正确的结论。
【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序。
【评价与反思】实验结束后,同学们对实验过程进行了如下反思:
(1)影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有 (任写一种)
(2)探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 进行判断(任写一种)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铅蓄电池在生产、生活中使用广泛.其构造示意图如图1,回答下列问题:
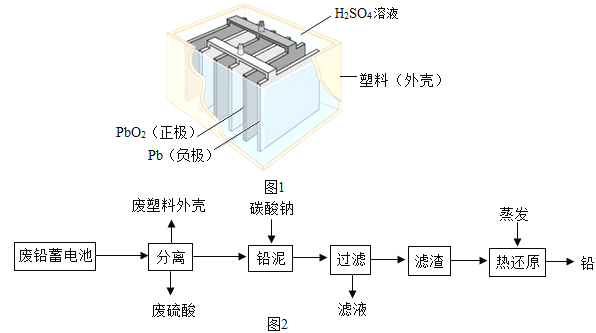
(1)铅蓄电池充电时是将电能转化为___________(填序号)
a、机械能 b、热能 c、化学能
(2)铅蓄电池放电过程中,反应的化学方程式为Pb+PbO2+2H2SO4═2PbSO4+2H2O,据此可知,铅蓄电池在放电时,溶液的pH不断___________(填“增大”、“减小”或“不变”).
(3)如图2是回收废铅蓄电池的一种工艺流程:
①从材料分类角度看,塑料是一类___________材料.
②废硫酸可以与氟磷灰石[Ca5(PO4)3F]反应,反应的化学方程式为2Ca5(PO4)3F+7H2SO4═3CaSO4+3Ca(H2PO4)2+2HF,反应产物中可用作化肥的物质是___________.
③如表是一些金属熔点的数据:
金属 | 锡 | 铅 | 铋 | 镉 |
熔点∕℃ | 231.9 | 327.5 | 271.3 | 320.9 |
日常所用保险丝由铋、铅、锡、镉等金属组成,其熔点约为___________(填序号)
A.300﹣320℃ B.230﹣250℃ C.60﹣80℃ D.20﹣40℃
④废硫酸直接排放会污染环境,拟选用如表物质中和后再排放:
物质 | CaCO3 | Ca(OH)2 | NH3 | NaOH |
市场参考价(元/kg ) | 1.8 | 2.0 | 6.5 | 11.5 |
已知:2NH3+H2SO4═(NH4)SO4,如果要求花最少的钱来中和等质量、等浓度的废硫酸,则应选择___________(填序号).
a、CaCO3 b、Ca(OH)2 c、NH3 d、NaOH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)氯气(Cl2)在净水、工业生产中用途广泛,用Cl2制备漂白液时有如下反应:Cl2+2NaOH==NaCl+NaClO+H2O,请回答下列问题:
①Cl-的原子结构示意图为 ,生成物NaClO中氯元素的化合价为 。
②20 ℃时,NaCl的溶解度为36 g。该温度下,饱和NaCl溶液中溶质与溶剂的质量之比为 。
(2)我们的星球因水而美丽,水也是宝贵的自然资源。
①电解水的化学方程式为 。
②生活用水在净化过程中常用 吸附色素和异味。一般可以通过 的方法降低水的硬度。
③Fe在高温条件下可与水蒸气反应生成一种单质和一种黑色的氧化物,该氧化物是磁铁矿的主要成分,写出该反应的化学方程式 。
(3)A~F是初中常见的化合物,有如下转化关系(部分生成物已省略)。其中A是大理石的主要成分,C可用于灭火,F俗名纯碱。
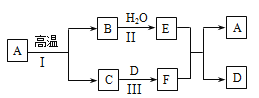
请回答下列问题:
①E的俗名为 ,写出物质E在农业上的一种用途 ,E与F反应的化学方程式为 。
②反应I的化学方程式为 ,该反应是 反应(填基本反应类型)。
③A、E均能与盐酸反应,反应的化学方程式分别为 、 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】由以下粒子结构示意图得出的结论错误的是 ( )

A.④表示的是阳离子 B.②④属于同种元素,①③属于另一种元素
C.②④形成的化合物是Al2O3 D.①③的化学性质相似
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com