(2008?遵义)碱式碳酸铜[化学式Cu
2(OH)
2CO
3,相对分子质量为222]加热完全分解后生成的黑色固体是什么?甲、乙、丙、丁四位同学对此进行探究.请你与他们一起,踏上探究之路.
(1)他们称取了2.5g碱式碳酸铜在试管中加热使之完全分解,冷却至室温后,称量黑色固体产物质量为1.8g.结合碱式碳酸铜的化学式,他们对黑色固体产物做出以下猜想:
a、可能是氧化铜; b、可能是炭粉; c、可能是氧化铜和炭粉的混合物.他们做出以上猜想的依据是
化学反应前后元素种类不变且氧化铜和炭粉都是黑色固体
化学反应前后元素种类不变且氧化铜和炭粉都是黑色固体
.
(2)甲同学从资料中得知:碳、氢气、一氧化碳在加热或高温条件下都能夺取一些金属氧化物中的氧,使其变为金属单质.他认为猜想C可以排除,理由是
炭粉与氧化铜在加热或高温的条件下能发生反应
炭粉与氧化铜在加热或高温的条件下能发生反应
.
(3)乙同学通过对得到的实验数据进行计算分析.排出了猜想b,他的理由是
2.5g×
≈0.14g<1.8g碱式碳酸铜中碳元素质量小于黑色固体的质量
2.5g×
≈0.14g<1.8g碱式碳酸铜中碳元素质量小于黑色固体的质量
.
(4)黑色固体究竟是什么?
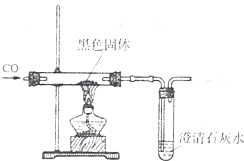
丙同学设计的实验方案:向盛有少量该黑色固体的试管中加入足量的稀硫酸,充分振荡后,静置观察.黑色固体消失,溶液变蓝.丁同学设计的实验方案(如右图所示):在盛有少量该黑色固体的玻璃管中,通入一氧化碳后加热.黑色固体逐渐变成光亮的红色,澄清石灰水变浑浊.他们根据实验现象都得出结论:黑色固体是氧化铜.丙、丁两同学的实验方案,
丙同学
丙同学
(填丙同学或丁同学)较好,谈谈你的看法:
丁同学方案需加热或操作复杂或易污染空气等
丁同学方案需加热或操作复杂或易污染空气等
.(简答一条)
(5)科学探究的方法和途径有多种,只要善于思考,就会有惊喜的发现.根据实验数据进行计算分析,也可以得出结论:黑色固体是氧化铜.理由是
设2.5g碱式碳酸铜能得到氧化铜的质量为x,根据质量守恒
Cu
2(OH)
2CO
3~2CuO
=x≈1.8g与生成黑色固体的质量相等,则黑色固体产物为氧化铜.
或2.5g碱式碳酸铜可转化为CuO的质量为:2.5g×
÷≈1.8g与生成黑色固体质量相等,则黑色固体产物为氧化铜.
设2.5g碱式碳酸铜能得到氧化铜的质量为x,根据质量守恒
Cu
2(OH)
2CO
3~2CuO
=x≈1.8g与生成黑色固体的质量相等,则黑色固体产物为氧化铜.
或2.5g碱式碳酸铜可转化为CuO的质量为:2.5g×
÷≈1.8g与生成黑色固体质量相等,则黑色固体产物为氧化铜.
.

 (2008?遵义)碱式碳酸铜[化学式Cu2(OH)2CO3,相对分子质量为222]加热完全分解后生成的黑色固体是什么?甲、乙、丙、丁四位同学对此进行探究.请你与他们一起,踏上探究之路.
(2008?遵义)碱式碳酸铜[化学式Cu2(OH)2CO3,相对分子质量为222]加热完全分解后生成的黑色固体是什么?甲、乙、丙、丁四位同学对此进行探究.请你与他们一起,踏上探究之路. 碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成.
碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成.