
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 产生蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多.振荡后沉淀不消失,很快沉淀逐渐变成黑色 |
| 实验操作 | 实验现象 |
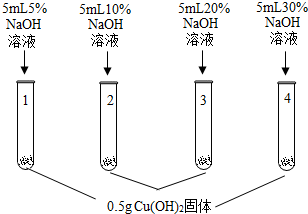 | 1号试管,… 2号试管,蓝色固体不消失 3号试管,蓝色固体减少 4号试管,蓝色固体消失,得到亮蓝色溶液 |
分析 根据硫酸铜和氢氧化钠反应产生氢氧化铜蓝色沉淀和硫酸钠,写出反应的方程式;
【猜想与假设】根据实验①的现象是沉淀消失,形成亮蓝色溶液,而不是产生黑色固体分析;
【解释与结论】(1)根据随着氢氧化钠溶液的浓度增大而氢氧化铜不断溶解进行解答;
(2)根据实验现象分析得出实验结论进行解答;
【反思与评价】(1)根据信息结合方程式的书写写出反应的方程式;
(2)根据现象及资料信息分析能量变化.
解答 解:硫酸铜溶液中存在的主要粒子的化学符号:Cu2+、SO42-、H2O;
硫酸铜和氢氧化钠反应产生氢氧化铜蓝色沉淀和硫酸钠,故反应的方程式为:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓;
【猜想与假设】根据实验①的现象是沉淀消失,形成亮蓝色溶液,而不是产生黑色固体,因此猜想Ⅰ认为蓝色沉淀消失可能是Cu(OH)2发生了分解是错误的;
【解释与结论】(1)随着氢氧化钠溶液的浓度增大而氢氧化铜不断溶解,所以1号试管中现象为:蓝色固体不消失;
(2)由实验现象可知,氢氧化铜能溶解在高于20%的NaOH中形成亮蓝色溶液;
【反思与评价】(1)氢氧化铜在氢氧化钠溶液中溶解生成铜酸钠,反应的化学方程式为2NaOH+Cu(OH)2=Na2Cu(OH)4;
(2)Cu(OH)2在室温下稳定,70℃-80℃时可脱水分解生成CuO,因此说明饱和CuSO4溶液与饱和NaOH溶液的反应是放热反应.
答案:Cu2+、SO42-、H2O;
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
【猜想与假设】氢氧化铜分解生成黑色的氧化铜固体;
【解释与结论】(1)蓝色固体不消失;
(2)氢氧化铜能溶解在高于20%的NaOH溶液中形成亮蓝色溶液;
【结论与反思】(1)2NaOH+Cu(OH)2=Na2Cu(OH)4
(2)蓝色沉淀逐渐变为黑色.
点评 本题属于信息题的考查,解题的依据是题目的信息结合已有的相关知识进行分析,能够考查学生的知识迁移能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
 甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )| A. | t1℃时甲的饱和溶液,升温至t2℃时仍是饱和溶液 | |
| B. | 乙的溶解度随温度的升高而增大 | |
| C. | 相同温度时,甲的溶解度一定大于乙的溶解度 | |
| D. | 分别将甲、乙的饱和溶液从t2℃降至t1℃时,所得溶液中溶质的质量分数相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
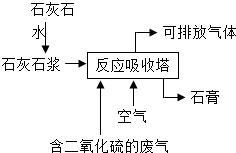 工业用石灰石浆吸收废气中的二氧化硫,并制取石膏(主要成分为硫酸钙).简易流程如图,主要的反应为:2CaCO3+2SO2+O2═2CaSO4+2X
工业用石灰石浆吸收废气中的二氧化硫,并制取石膏(主要成分为硫酸钙).简易流程如图,主要的反应为:2CaCO3+2SO2+O2═2CaSO4+2X查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NO3-、Cl-、Na+、Ag+四种离子能在pH=2的水溶液中大量共存 | |
| B. | 可用氢氧化钙溶液除去氢氧化钠溶液中含有的少量碳酸钠 | |
| C. | 将铜粉放入到硫酸亚铁溶液中,溶液由浅绿色变为蓝色 | |
| D. | 用燃着的木条可以将氧气、氮气、二氧化碳区别开来 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 收集满一试管的纯净气体,用燃着的木条伸入试管内 | 气体没有燃烧,木条熄灭 | 猜想(1)(2)不成立 |
| 将气体通入装有澄清石灰水的试管中 | 澄清石灰水变浑浊 | 猜想(3)成立,其反应方程式为SO2+Ca(OH)2=CaSO3↓+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
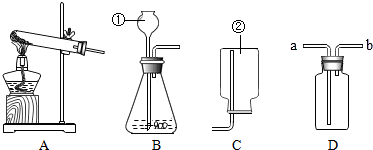 根据如图所示实验装置回答问题:
根据如图所示实验装置回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
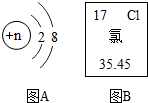 如图所示为某粒子的结构示意图和氯元素在元素周期表中的信息,请按要求填空.
如图所示为某粒子的结构示意图和氯元素在元素周期表中的信息,请按要求填空.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com