
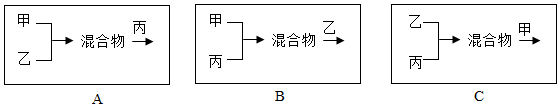
| 甲 | 乙 | 丙 |
| Ba(OH)2、NaOH | NaCl、Na2CO3 | HCl、NaCl |
 .
. 分析 (1)根据氢氧化钡与碳酸钠的反应写出反应的化学方程式;
(2)根据碳酸钠与盐酸的反应分析回答;
(3)根据甲、乙、丙的成分分析,将三个车间的废液样品混合,过滤.得到无色溶液和白色沉淀.无色溶液中一定含有NaCl,白色沉淀应是碳酸钡,说明了盐酸不足.据此分析溶液中的成分.
(4)根据酸、碱、盐的性质,分析混合反应后生成的物质,找出符合题意的选项.
解答 解:(1)在方案一中,甲车间废液中加入适量的Na2CO3 溶液,碳酸钠能与氢氧化钡反应生成了碳酸钡沉淀和氢氧化钠,该反应的化学方程式为:Na2CO3+Ba(OH)2═BaCO3↓+2NaOH;
(2)方案二,乙、丙两车间的废液按适当比例混合后,碳酸钠恰好与稀盐酸反应生成了氯化钠,可得到一种溶质为氯化钠的中性溶液
(3)由题意可知,将三个车间的废液样品混合,过滤.得到无色溶液和白色沉淀,白色沉淀是碳酸钡,在生成碳酸钡同时生成了氢氧化钠,能生成了碳酸钡,说明了盐酸没有剩余,无色溶液中一定含有NaCl、氢氧化钠.
A. 由于溶液中含有氢氧化钠,若只加入MgSO4 溶液,能观察到明显现象,生成了白色沉淀,故A正确;
B. 由于溶液中含有氢氧化钠,碳酸钠溶液显碱性,都能使石蕊试液变成蓝色,若加入过量的Na2CO3 溶液后,再滴加石蕊溶液,没有明显的现象,故C错误;
C. 若溶液中不含有碳酸钠,若加入过量的中性BaCl2 溶液后,没有现象,故C错误;
(4)A、甲乙混合生成了碳酸钡沉淀,在加入稀盐酸时,碳酸钡与稀盐酸反应生成了氯化钡,不会生成碳酸钡沉淀,故A错误;
B、甲丙混合生成了氯化钡,在加入碳酸钠时生成了碳酸钡沉淀,故B符合题意;
C、乙丙混合时,碳酸钠与稀盐酸反应生成了氯化钠,再与甲混合时不会生成碳酸钡沉淀,故C错误.
故答为:(1)Na2CO3+Ba(OH)2═BaCO3↓+2NaOH;(2)氯化钠;(3)A;(4)B.
点评 本题主要考查了酸碱盐的知识和方程式的书写,了解酸碱盐的性质是解答本题的基础知识.


 优等生题库系列答案
优等生题库系列答案科目:初中化学 来源: 题型:选择题
| A. | 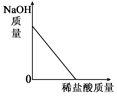 | B. | 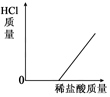 | C. | 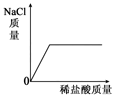 | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
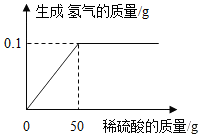 黄铜是铜锌合金,它可用来制造机器的零件等.某化学课外兴趣小组为测定某黄铜样品中铜的含量(不考虑样品中的杂质).(1)黄铜样品完全反应生成氢气的质量为0.1g
黄铜是铜锌合金,它可用来制造机器的零件等.某化学课外兴趣小组为测定某黄铜样品中铜的含量(不考虑样品中的杂质).(1)黄铜样品完全反应生成氢气的质量为0.1g查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | B. | 甲烷+氧气$\stackrel{点燃}{→}$水+二氧化碳 | ||
| C. | 过氧化氢$\stackrel{MnO_{2}}{→}$水+氧气 | D. | 氢气+氧化铜$\stackrel{△}{→}$铜+水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
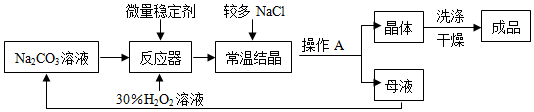
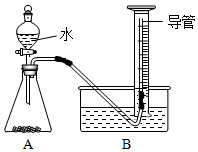
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 溶液一定是无色透明的 | |
| B. | 降温时饱和溶液可能无晶体析出 | |
| C. | 温度升高,某饱和溶液中溶质的质量分数一定减少 | |
| D. | 将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁粉和木炭粉--用磁铁吸引 | |
| B. | 合成纤维和羊毛纤维--取样品灼烧 | |
| C. | 黄金和黄铜(铜锌合金)--观察颜色 | |
| D. | 硝酸铵固体和氢氧化钠固体--加水溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 冶炼方法 | 反应表示式(其他产物已略去) | 代表性金属 |
| 热还原法 | 金属A的氧化物+还原剂$\frac{\underline{\;加热\;}}{\;}$金属A | 锌、铜 |
| 电解法 | 金属B的化合物$\frac{\underline{\;通电\;}}{\;}$金属B | 钾、铝 |
| 热分解法 | 金属C的氧化物$\frac{\underline{\;加热\;}}{\;}$金属C | 汞、银 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com