
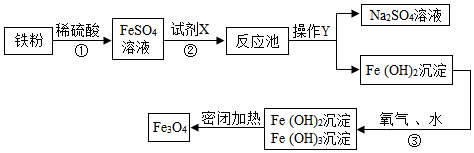
分析 硫酸亚铁能和氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,氢氧化钠溶液显碱性,能使酚酞试液变红色;
氢氧化亚铁能和水、氧气反应生成氢氧化铁.
解答 解:(1)硫酸亚铁能和氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,因此试剂X是氢氧化钠溶液;
判断加入的氢氧化钠溶液过量的方法是:取少量反应池中的溶液于试管中,滴加酚酞试液,溶液变红色,说明氢氧化钠溶液已经过量.
故答案为:氢氧化钠溶液;取少量反应池中的溶液于试管中,滴加酚酞试液,溶液变红色,说明氢氧化钠溶液已经过量.
(2)反应③中,氢氧化亚铁能和水、氧气反应生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故填:4Fe(OH)2+2H2O+O2=4Fe(OH)3.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:初中化学 来源: 题型:选择题
| A. | 洗涤剂清除油污利用了乳化功能 | |
| B. | 天然气泄漏,立即关闭阀门并开窗通风 | |
| C. | 在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀 | |
| D. | 炒菜时油锅着火,立即用水浇灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
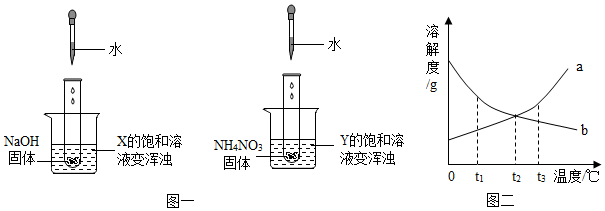
| A. | Y的溶解度曲线为b曲线 | |
| B. | 降温可使X的饱和溶液变浑浊 | |
| C. | X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变大 | |
| D. | t3℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
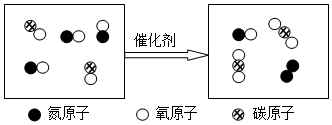
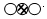 ”表示的物质属于②.(选填序号).
”表示的物质属于②.(选填序号).查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com