
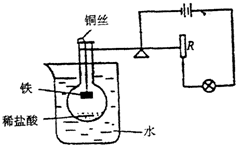
 将一盛有一定质量稀盐酸的圆底烧瓶放进一个盛有水的大烧杯中,圆底烧瓶处于漂浮状态,烧瓶中细铜丝悬挂小块铁,烧瓶浸入水中的体积如图所示,烧瓶连结的杠杆与电路相连,小心将铁块浸入盐酸中,充分反应待静止后,灯泡的亮度的变化是
将一盛有一定质量稀盐酸的圆底烧瓶放进一个盛有水的大烧杯中,圆底烧瓶处于漂浮状态,烧瓶中细铜丝悬挂小块铁,烧瓶浸入水中的体积如图所示,烧瓶连结的杠杆与电路相连,小心将铁块浸入盐酸中,充分反应待静止后,灯泡的亮度的变化是科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 金属 | 镁 | 铁 | 铜 |
| 反应现象 | 反应剧烈 | 反应较缓慢 | 不反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 某活动小组的同学对碳酸钠与稀盐酸反应进行了下列探究:
某活动小组的同学对碳酸钠与稀盐酸反应进行了下列探究:
【探究一】向放有一支燃着的蜡烛的烧杯中加适量碳酸钠和盐
酸(如图所示):
(1)蜡烛燃烧变化的现象是: 。
(2)根据该实验现象推测碳酸钠与盐酸反应产生的气体可用于 (写出用途)。
【探究二】利用碳酸钠与盐酸的反应,可否用于验证质量守恒定律进行了探究,实验如下:
|
 如右图所示,在(吸滤)瓶中加入适量的碳酸钠粉
如右图所示,在(吸滤)瓶中加入适量的碳酸钠粉 末,在小试管中加入盐酸。将小试管放入吸滤瓶中,
并用止水夹夹住支管处的橡皮管。称量整个装置的
质量,记录读数。将吸滤瓶倾斜,使小试管中的盐
酸倾倒入瓶中,与碳酸钠粉末反应。可观察到如图二
所示的现象。再次称量整个装置的质量,记录读数。
两次读数 (填“是”或“否”)相等。理由是 。
【探究三】碳酸钠与盐酸反应后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质溶于水,不参加反应且呈中性)。甲、乙两同学分析认为剩余溶液中一定含有氯化钠,可能有盐酸或碳酸钠。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钠溶液呈中性
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加 试液[ | 试液变红 | 有盐酸 |
| 乙 | 取样于试管中,逐滴滴加碳酸钠溶液[ |
|
【探究四】某兴趣小组同学向盛有6.0g纯碱样品的烧杯里加入40.0g盐酸,实验测定完全反应后烧杯中剩余物的质量为43.8g,且溶液显酸性。(假设纯碱样品中的杂质不与盐酸反应)求:
(1)产生的二氧化碳的质量为 g。
(2)纯碱样品中碳酸钠的质量(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com