
分析 (1)浓硫酸具有吸水性,在空气中溶液中的溶剂变多溶液变稀;
(2)根据化学方程式的书写步骤书写;
(3)在稀释浓硫酸时,必须将浓硫酸注入水中,并不断搅拌.如果不慎将浓硫酸溅到皮肤或衣服上时,要用大量水冲洗,以洗掉较多的硫酸;
(4)根据质量守恒定律进行分析.
解答 解:(1)浓盐酸具有挥发性,溶液由于氯化氢气体的跑出而使溶质质量减轻;浓硫酸具有吸水性,在空气中易吸收空气中的水蒸气而使溶液质量变大,溶质量不变而溶质质量分数减小;
(2)Al(OH)3与盐酸反应生成氯化铝和水,化学方程式为:3HCl+Al(OH)3=AlCl3+3H2O;
(3)稀释浓硫酸时要把浓硫酸倒入水中,同时用玻璃棒不断搅拌,使热量尽快散失,且不可将水倒入浓硫酸里,会造成酸液飞溅,由于浓硫酸具有较强的腐蚀性,所以沾在皮肤或衣服上时应立即用大量的水清洗,并涂上涂上3%~5%的碳酸氢钠溶液;
(4)反应前后原子的种类和个数不变,由此推断“□”中物质的化学式是HCl.
故答案为:(1)浓硫酸;
(2)3HCl+Al(OH)3=AlCl3+3H2O;
(3)大,需要;
(4)HCl.
点评 本题难度不大,掌握酸的性质是正确解答本题的关键.


 口算能手系列答案
口算能手系列答案科目:初中化学 来源: 题型:选择题
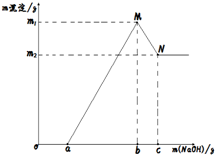 已知:MgSO4+2NaOH═Mg(OH)2+Na2SO4,Al2(SO4)3+6NaOH═2Al(OH)3+3Na2SO4,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,现剪取wg镁铝合金的易拉罐壳,先用过量硫酸溶解,然后再向溶液中滴加NaOH溶液,反应符合下列图象关系(横坐标表示滴加NaOH溶液的质量,纵坐标表示生成沉淀质量),则下列说法不正确的是( )
已知:MgSO4+2NaOH═Mg(OH)2+Na2SO4,Al2(SO4)3+6NaOH═2Al(OH)3+3Na2SO4,Al(OH)3+NaOH═NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,现剪取wg镁铝合金的易拉罐壳,先用过量硫酸溶解,然后再向溶液中滴加NaOH溶液,反应符合下列图象关系(横坐标表示滴加NaOH溶液的质量,纵坐标表示生成沉淀质量),则下列说法不正确的是( )| A. | a点表示NaOH溶液与剩余的硫酸恰好完成反应 | |
| B. | 在M点时,溶液中有两种溶质 | |
| C. | N点表示Al(OH)3沉淀刚好完成溶于NaOH溶液 | |
| D. | 生成氢氧化镁沉淀的质量为(m1-m2)g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 该反应为复分解反应 | B. | 生成的C和D均为氧化物 | ||
| C. | 反应可表示为 A+2B$\frac{\underline{\;点燃\;}}{\;}$C+2D | D. | 生成C和D的质量比为11:9 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/克 | 35 | 35 | 35 | 35 |
| 剩余固体质量/克 | 9.1 | 8.2 | 7.3 | 6.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
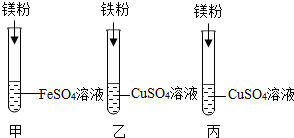 某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:
某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com