
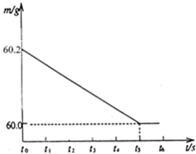
 将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示:
将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示:| 56 |
| 2 |
| x |
| 0.2g |
| 5.6g |
| 5.82g |


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2013-2014学年湖南省长沙市长郡麓山国际实验学校九年级中考二轮模拟化学试卷(解析版) 题型:计算题
将某生铁(铁和碳的合金)样品5.8克投入到100克稀盐酸中恰好完全反应,剩余黑色不溶物0.2克,求该稀盐酸的质量分数是多少?(相对原子质量H:12,? Cl:35.5,? Fe :56 )
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
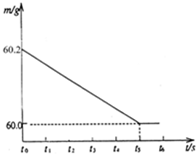 将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示:
将某生铁样品5.82g,放入烧杯中,再加入过量的稀盐酸,反应时间(t)和烧杯及其所盛物质总质量(m)的关系如图所示:查看答案和解析>>
科目:初中化学 来源:2012年陕西省中考化学冲刺预测试卷(十一)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com