
【题目】(5分) 下图是实验室常用的装置。请据图回答:
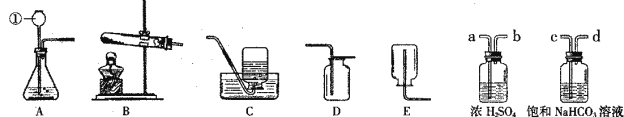
(1)写出仪器①的名称 。收集某气体只能采用E装置,由此推测该气体具有的性质 ;
(2)用高锰酸钾制取氧气的装置组合是 (填序号),反应的化学方程式为 ;
(3)实验室制得的CO2气体中常含有HCl和水蒸气。为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项)。
A.a→b→c→d B.b→a→c→d
C.c→d→a→b D.d→c→b→a
【答案】(5分) (1)长颈漏斗,可溶于水且密度比空气小
(2)B、C或D 2KMnO4 ![]() K2MnO4+MnO2+O2↑ (3)C
K2MnO4+MnO2+O2↑ (3)C
【解析】(1)根据图形写出仪器的名称,根据收集方法推出物质的密度和溶解性.
(2)根据实验室制取氧气的原理和实验装置回答.
(3)根据实验目的和气体的性质以及洗气的方法来选择顺序.
解答:解:(1)仪器的名称是长颈漏斗,该气体只能用向下排空气法收集,说明它密度比空气小,不能用排水法说明它能溶于水.
(2)用高锰酸钾制取氧气需要反应物是固体且需要加热的装置,收集氧气可用排水法和向上排空气法,故选择B、C或D;反应的化学方程式为2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)除去CO2中HCl和水蒸气,要先用碳酸氢钠溶液除氯化氢,后用浓硫酸除水,气体进入洗气瓶时要长管进,短管出,故选C.
答案:(1)长颈漏斗,可溶于水且密度比空气小
(2)B、C或D 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)C


科目:初中化学 来源: 题型:
【题目】请用化学用语表示下列物质或微粒:
(1)4个氧原子___________;
(2)2个铝离子___________;
(3)由2个氮原子构成的一个分子___________;
(4)2个碳酸钠___________;
(5)正三价氮元素所形成的氧化物___________;
(6)氯酸钾(KClO3)是由钾离子和氯酸根(ClO3-)离子构成,则氯酸钙的化学式为___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
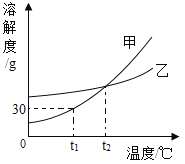
A. 甲的溶解度比乙的大
B. t2℃时,甲、乙两种物质的溶解度相等
C. t1℃时,将50g水与20g甲混合,可以得到70g溶液
D. 将t2℃时甲物质的饱和溶液降温到t1℃,溶液中溶质的质量分数没有变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图是 X、Y 两种微粒的结构示意图。下列说法正确的是( )

A.X 为原子,Y 为离子
B.X、Y 均属于非金属元素
C.X 在反应中可失去 6 个电子
D.X 与 Y 形成化合物的化学式为 YX
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活生产息息相关,请运用化学知识回答以下问题
(1)我们通常把含有较多可溶性钙、镁化合物的水叫_____.加入_____可以鉴别.
(2)某“组合转化”技术是将CO2和H2在催化剂和加热条件下转化为化工原料乙烯(C2H4)和水,请写出该反应的化学方程式:_____.
(3)采用碳纤维材料的自行车轻便、机械强度大,这应用了碳纤维的_____(“物理”或“化学”)性质:采用铝合金材料的自行车,金属铝具有较强抗腐蚀性的原因_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某碳酸钠样品中杂质氯化钠的质量,李明同学进行了三次实验,反应的化学方程式为:Na2CO3+CaCl2===CaCO3↓+2NaCl。实验数据如下表:
编号 | 第1次 | 第2次 | 第3次 |
所取固体样品的质量/g | 7 | 5 | 5 |
加入氯化钙溶液的质量/g | 50 | 50 | 75 |
反应后生成沉淀的质量/g | 4 | 4 | 4 |
完成下列计算:
(1)碳酸钠样品中碳酸钠的质量是多少?
(2)第三次实验中充分反应后所得溶液中氯化钠的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类的生产生活离不开金属.
(1)在地壳里含量最多的金属元素与非金属元素组成的化合物是(填化学式)__.
(2)下列铜制品的用途中,利用金属导电性的是__(填字母).

(3)铜在潮湿的空气中也能“生锈”形成铜绿,铜绿的主要成分为 Cu2(OH)2CO3.由此可以推测:铜“生锈”过程中,参与反应的物质有铜、氧气、水和__.
(4)下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.金属大规模被使用的先后顺序跟__(填字母)关系最大.
A.地壳中金属元素的含量 B.金属的导电性 C.金属的活动性
(5)世界上每年因为生锈而报废的铁制品占年总产量的20%﹣40%,保护金属资源,人人有责,请写出一条防止铁生锈的措施__.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组向甲、乙试管中各加入2mL 10%的CuSO4溶液,再向两支试管中加入10%的NaOH溶液,甲试管中加入5mL、乙试管中加入2滴,振荡后观察到甲试管中有蓝色沉淀生成,乙试管中有浅绿色沉淀生成。
(实验讨论)得到的蓝色沉淀一定是氢氧化铜,写出反应的化学方程式:_____,那么浅绿色沉淀是什么呢?
(查阅资料)(1)NaOH溶液和CuSO4溶液反应可生成碱式硫酸铜,它是浅绿色固体,受热会分解;
(2)碱式硫酸铜有多种可能的组成,如Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4;
(3)SO2气体能使酸性高锰酸钾溶液褪色。
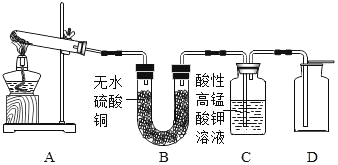
(实验探究)该小组对碱式硫酸铜产生了兴趣,想探究碱式硫酸铜受热分解的产物。
(实验设计)取少量碱式硫酸铜加入试管中并按以下流程进行实验:
实验结束后,试管A中残留有黑色固体,滴入稀硫酸后观察到_____的现象,证明该黑色固体是氧化铜;B中无水硫酸铜变为蓝色,证明有水生成;C中酸性高锰酸钾溶液褪色,证明生成_____;D中气体能使带火星木条复燃,证明有_____生成;
(实验反思)
(1)当NaOH溶液和CuSO4溶液反应时,只要CuSO4溶液的量一定,NaOH溶液_____(填“过量”或“不足”)时就能生成浅绿色沉淀;
(2)碱式硫酸铜可表示为:aCu(OH)2bCuSO4,如将Cu4(OH)6SO4改写该表示方式,则a与b的比值为_____;
(拓展延伸)当反应物的量不同,产物可能不同,试另举一个例子:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是水果电池,制作方法是将铝片、铜片打磨后,一起插入新鲜橙子里面, 观察到灯泡发光。通常用活动性较强的金属做负极, 活动性较弱的做正极,利用橙汁内可导电的有机酸形成稳定的电流。
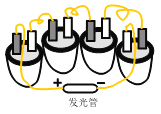
(1)铝、铜可做电极,利用了金属的_____性。
(2)实验前,铝片和铜片要打磨的原因是_____。
(3)在这个水果电池中做正极的金属是_____。
(4)为比较铜和铝的金属活动性顺序,可以选择铝片和一种盐溶液 ,该盐溶液是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com