
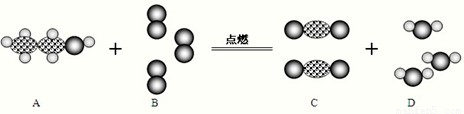
 ”表示氧原子,“
”表示氧原子,“ ”表示碳原子,“
”表示碳原子,“ ”表示氢原子.
”表示氢原子. 2CO2+3H2O,然后根据反应特点判断反应类型.
2CO2+3H2O,然后根据反应特点判断反应类型. 2CO2+3H2O.
2CO2+3H2O.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:初中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
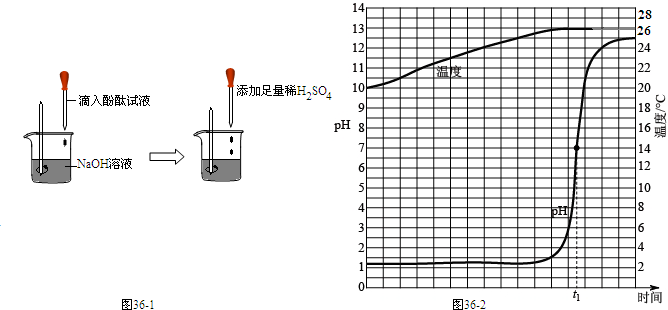
 37、如图所示,某同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂.为了确定盐酸与氢氧化钠是否完全反应,该同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是他得出“两种物质已恰好完全中和”的结论.
37、如图所示,某同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂.为了确定盐酸与氢氧化钠是否完全反应,该同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是他得出“两种物质已恰好完全中和”的结论.
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 相关化学反应方程式 | ||||
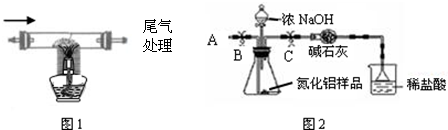
| 1.除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为 2Cu+O2
| ||||
| 2.用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3
|
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 阴离子 阳离子 |
OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
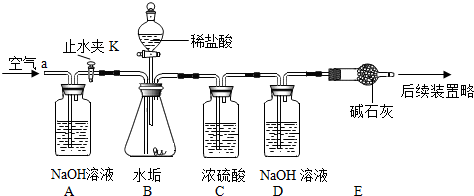
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 没有白色沉淀产生 | 水垢中 不含Ca(OH)2 不含Ca(OH)2 . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止.
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止.| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积( mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度 (℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
| 装置A | 装置B | |
| 长玻璃导管中现象 | 红墨水在长玻璃管中上升较快 红墨水在长玻璃管中上升较快 |
红墨水在长玻璃管中上升较慢 红墨水在长玻璃管中上升较慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com