
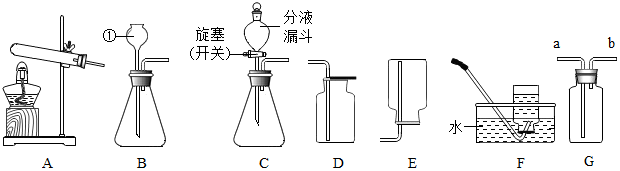
分析 (1)根据实验室常用仪器解答;
(2)根据A装置制取气体的反应物是固体,反应条件是加热,可以是制取氧气,氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气进行分析;
(3)①根据二氧化碳的密度比空气的大,易溶于水解答;
②根据二氧化碳不支持燃烧解答;
③根据气体的性质分析解答;
(4)分液漏斗可以控制液体的滴加速度进行分析;
(5)根据实验室制取氢气的反应物是固体和液体,反应条件是常温,氢气的密度比空气小,难溶于水进行分析.
(6)根据质量守恒定律可知:反应后比反应前减少的质量是生成二氧化碳的质量;根据化学方程式由二氧化碳的质量可以计算出样品中活性碳酸钙的质量,进而计算出样品中活性碳酸钙的质量分数石.
解答 解:(1)根据实验室常用仪器可知:①是长颈漏斗;
(2)A装置制取气体的反应物是固体,反应条件是加热,可以是制取氧气,试管口无棉花,可以用氯酸钾在二氧化锰制氧气,氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)①二氧化碳的密度比空气的大,易溶于水,可以用向上排空气法收集,故选D;
②若用D装置收集氧气则验满的方法是用带火星的木条伸在集气瓶瓶口,若木条复燃证明已满;
③已知某气体可用E装置收集,说明气体的密度比空气的小,若改用G装置收集,则该气体应从b进;
(4)分液漏斗可以控制液体的滴加速度,所以发生装置可选择B和C相比较,C的主要优点是可以控制反应的速率;
(5)实验室制取氢气的反应物是固体和液体,反应条件是常温,氢气的密度比空气小,难溶于水,所以发生装置选B或C,收集装置选E或F.
(6)根据质量守恒定律可知反应前后减少的质量就是生成的生成二氧化碳的质量,是21g+100g-112.2g═8.8g
设样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2
100 44
x 8.8g
$\frac{100}{x}=\frac{44}{8.8g}$
x═20g
样品中活性碳酸钙的质量分数为:$\frac{20g}{21g}$2×100%═95%
故答案为:(1)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑,可以控制反应的速率;
(3)B或C,E或F.
答案:(1)长颈漏斗;
(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)①D; ②用带火星的木条伸在集气瓶瓶口,若木条复燃证明已满. ③b;
(4)可以控制反应的发生与停止(可以控制反应速率);
(5)B、E (或 B、F 或 C、E 或 C、F)
(6)95%
点评 题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铜芯线和铝芯线 | B. | 食盐和白糖 | C. | 酒精和汽油 | D. | 白酒和纯净水 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
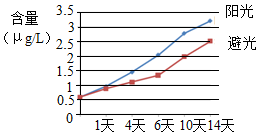 阅读下面科普短文.
阅读下面科普短文.| 样品类别 | 数量 | 微生物超标数 | 微生物超标率/% |
| 动态实验样品(72小时) | 15 | 14 | 93.0 |
| 静态实验样品(1个月) | 13 | 2 | 15.4 |
| 加热时间/h | 0 | 1 | 3 | 6 | 12 | 24 | 36 |
| 含量/μg/L | 0.67 | 0.73 | 1.12 | 1.23 | 1.81 | 2.44 | 3.53 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com