
含氨
15%的氨水2千克,稀释到含氨0.3%时,需要加水[
]|
A .98千克 |
B .100千克 |
|
C .102千克 |
D .104千克 |
|
若按一般计算过程解这个题,则可分几步求出答案: (1)2 千克15%的氨水中含氨质量:2×15%=0.3(千克)(2) 含0.3千克氨的质量分数为0.3%的氨水质量:0.3 千克÷0.3%=100千克(3) 浓氨水稀释时需加水的质量:100千克-2千克=98千克还有一种简单计算法.即“十字交叉”法,计算这种类型的题目比较简便迅速.这种方法可表示为:
其中: A表示浓溶液的质量分数;B 表示稀溶液的质量分数,若是水,则B为0;C 表示浓、稀溶液混合后的质量分数;D 为C与B的差;E 为A与C的差;D 与E的比值.即浓溶液与稀溶液混合时的质量比,由于D与E只求比值,所以A、B与C在上式中可以弃去百分符号(%)取值.以上题为例,用十字交叉法求解为:
即用 15%的氨水与水配制成0.3%的氨水时,15%的氨水与水的质量比为0.3∶14.7即1∶49.题干中15%氨水的质量为2千克,则需水98千克.用这种解法;就简便多了. |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:初中化学 来源: 题型:阅读理解
(8分)
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。
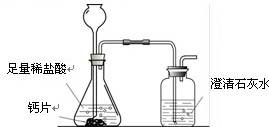
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
| 加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
| 充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
【分析和评价】
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是 。
【结论】经过计算,该钙片中碳酸钙的质量分数是 。
查看答案和解析>>
科目:初中化学 来源:2010年-2011年度北京市延庆区初三第一学期期末化学卷 题型:实验探究题
(8分)
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。
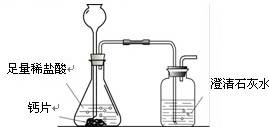
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
|
钙片质量 |
空洗气瓶质量 |
澄清石灰水的质量 |
反应后洗气瓶及瓶内物质总质量 |
|
25 g |
100 g |
200 g |
300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
|
加入稀盐酸的质量 |
100 g |
200 g |
300 g |
400 g |
|
充分反应后烧杯及杯内物质总质量 |
222.8 g |
320.6 g |
418.4 g |
518.4 g |
【分析和评价】
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是 。
【结论】经过计算,该钙片中碳酸钙的质量分数是 。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
(1) 补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
(2) 碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
(3) 常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4) 澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。

| |||||
| |||||
| |||||
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
| 加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
| 充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
【分析和评价】
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以 进行该实验),原因是 。
进行该实验),原因是 。
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是 。
【结论】经过计算,该钙片中碳酸钙的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com