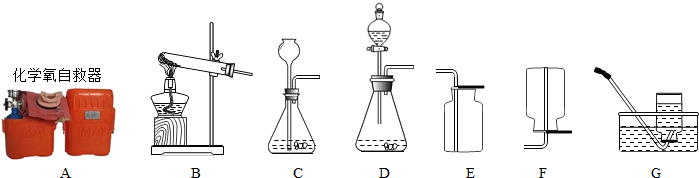
解:(1)熟记常用仪器的名称可知a为铁架台,b为锥形瓶.
(2)实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,反应物是固态和液态,反应条件是常温,应选固-液不加热型的发生装置;二氧化碳的密度比空气大,能溶于水,只能用向上排空气法收集,氧气的密度比空气大,不易溶于水,可用排水法或向上排空气法收集,二氧化碳和氧气都可用向上排空气法收集.故答案为:A D
(3)实验室制氧气的三种方法中加热氯酸钾或加热高锰酸钾这两种方法选用固-固加热型的发生装置,氯酸钾以二氧化锰为催化剂加热生成氯化钾和氧气,高锰酸钾加热生成锰酸钾、二氧化锰和氧气;用排水法收集气体时集气瓶要装满水,否则集气瓶中有残余的空气,收集的气体不纯,刚开始冒气泡时不能收集,因为刚开始排出的气体中有装置中的空气,应等到气泡均匀冒出时再收集.故答案为:2KClO
3
2KCl+3O
2↑或2KMnO
4
K
2MnO
4+MnO
2+O
2↑
导管口刚有气泡冒出就开始收集或集气瓶未装满水
(4)反应物的量、温度、发生装置等都要相同;从过氧化氢溶液的浓度、反应温度、反应容器的大小等因素进行探究.故答案为:取相同体积的过氧化氢溶液、在相同温度下实验、用相同的发生装置 不同浓度的过氧化氢溶液对该反应的反应速率是否有影响或温度对该反应的反应速率是否有影响或反应容器的大小对该反应速率是否有影响
分析:(1)a、b均为实验室常用的仪器.
(2)根据反应物的状态和反应条件确定发生装置,根据气体的密度和溶水性确定收集装置.
(3)选用B装置应满足的条件是反应物的状态是固态,反应条件是加热;从用排水法收集氧气的注意事项进行分析.
(4)除二氧化锰的量不同以外其余的条件都要相同;看其它因素对该反应的反应速率是否有影响.
点评:本道题的难点是第四小题,应用控制变量法进行分析,即改变一个量,保持其它量都不变.


 2KCl+3O2↑或2KMnO4
2KCl+3O2↑或2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (1)写出指定仪器的名称:①
(1)写出指定仪器的名称:①