
美丽的青海湖不仅让我们感受到自然之美,当地的居民还能从青海湖内“冬天捞碱、夏天捞盐”.当地学校的某化学兴趣小组对捞出来的纯碱进行研究,有的同学认为捞出来的全是碳酸钠,有的同学认为捞出来的纯碱中混有少量的氯化钠.现在他们准备以一包冬天捞出来的纯碱(若含有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的质量分数.小组通过讨论设计了下图中的装置,请你参与探究.(实验前活塞都关闭)
【实验一】称取13.25g纯碱样品完全溶于水,放入甲中,称量丙装置的质量为355g,打开b、c,甲中现象为 时,再称量丙装置的质量为359.4g,通过计算得出纯碱样品中碳酸钠的质量分数为 .甲和丙中反应的化学方程式为 、 .同学们通过讨论认为上述方法并不能准确测量,其理由可能是 .(写一条即可)
【实验二】通过讨论,改进后的实验步骤如下:
①称量丙装置的质量.
②称量样品,检查装置气密性.
③关闭a,打开b,注入足量的稀盐酸.
④打开a、d,鼓入氮气一会儿.
其正确顺序为 ② (填字序号,可重复).
【表达与交流】
(1)此实验中丁装置的作用是 .
(2)此实验中鼓入氮气的作用是 .
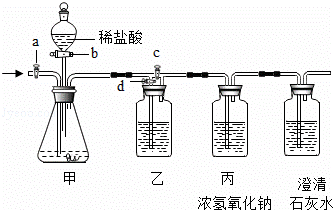
| 向甲中加入稀盐酸时,甲中的碳酸钠和稀盐酸反应能生成氯化钠、水和二氧化碳,当碳酸钠完全反应时,不再产生气泡,通过数据可以计算碳酸钠的质量分数; 测定反应生成的二氧化碳的质量时,装置中的空气中含有二氧化碳,对实验结果会产生一定的影响,反应前应该把装置中的空气排尽,反应后应该把装置中的二氧化碳完全排入丙中; 空气中的二氧化碳进入丙中时,也会影响实验结果,应该采取措施防止空气中的二氧化碳进入丙中. | |
| 解答: | 解:【实验一】 甲中不再产生气泡时,说明已经完全反应. 故填:不再产生气泡. 反应生成的二氧化碳的质量为:359.4g﹣355g=4.4g, 设样品中碳酸钠的质量为X, Na2CO3+2HCl=2NaCl+H2O+CO2↑ 106 44 X 4.4g
X=10.6g 纯碱样品中碳酸钠的质量分数为: 故填:80%. 碳酸钠和稀盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑. 故填:Na2CO3+2HCl=2NaCl+H2O+CO2↑. 二氧化碳和氢氧化钠反应能生成碳酸钠和水,化学方程式为:CO2+2NaOH=Na2CO3+H2O. 故填:CO2+2NaOH=Na2CO3+H2O. 上述方法并不能准确测量,这是因为装置中的空气没有排净,其中含有二氧化碳,产生的二氧化碳没有被氢氧化钠溶液完全吸收等. 故填:装置中的空气没有排净,其中含有二氧化碳. 【实验二】 改进后的实验步骤应该是,先称量样品,检查装置气密性,打开a、d,鼓入氮气一会儿,把装置中的空气排尽,称量丙装置的质量,关闭a,打开b,注入足量的稀盐酸,再打开a、d,鼓入氮气一会儿,使二氧化碳完全被氢氧化钠溶液吸收,再称量丙装置的质量. 故填:②④①③④①. 【表达与交流】 (1)此实验中丁装置的作用是:检验产生的二氧化碳已被完全吸收,同时防止空气中的二氧化碳进入丙中. 故填:检验产生的二氧化碳已被完全吸收,同时防止空气中的二氧化碳进入丙中. (2)此实验中鼓入氮气的作用是:开始时将装置中的空气排净,结束时将产生的二氧化碳全部排入氢氧化钠溶液中吸收. 故填:开始时将装置中的空气排净,结束时将产生的二氧化碳全部排入氢氧化钠溶液中吸收. |


科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| a |
| b |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| a |
| b |
| 53 |
| 22 |
| 53b |
| 22a |
| 53b |
| 22a |
查看答案和解析>>
科目:初中化学 来源:2013年北京市通州区中考二模化学试卷(解析版) 题型:探究题
美丽的青海湖不仅让我们感受到自然之美,当地的居民还能从青海湖内“冬天捞碱、夏天捞盐”。当地学校的某化学兴趣小组对捞出来的纯碱进行研究,有的同学认为捞出来的全是碳酸钠,有的同学认为捞出来的纯碱中混有少量的氯化钠。现在他们准备以一包冬天捞出来的纯碱(若含有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的质量分数。小组通过讨论设计了下图中的装置,请你参与探究。(实验前活塞都关闭)
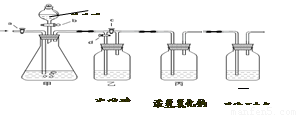
【实验一】称取13.25g纯碱样品完全溶于水,放入甲中,称量丙装置的质量为355g,打开
b、c,甲中现象为 时,再称量丙装置的质量为350.6g,通过计算得出纯碱样品中
碳酸钠的质量分数为 。甲和丙中反应的化学方程式为 、 。
同学们通过讨论认为上述方法并不能准确测量,其理由可能是 。(写一条即可)
【实验二】通过讨论,改进后的实验步骤如下:
①称量丙装置的质量。
②称量样品,检查装置气密性。
③关闭a,打开b,注入足量的稀盐酸。
④打开a、d,鼓入氮气一会儿。
其正确顺序为 (填字序号,可重复)。
【表达与交流】
(1)此实验中丁装置的作用是 。
(2)此实验中鼓入氮气的作用是 。(2分)
查看答案和解析>>
科目:初中化学 来源:2012年江苏省苏州市常熟市中考化学调研试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com