
 如图是某同学在探究金属活动性顺序时所做实验,通过实验现象不能得到的结论是
如图是某同学在探究金属活动性顺序时所做实验,通过实验现象不能得到的结论是

科目:初中化学 来源: 题型:阅读理解


| 实验操作 | 实验现象 | 结论 |
| I.取少量的金属粉末于试管中,加入足量的 氢氧化钠溶液 (填试剂名称). |
有气泡产生(或固体减少) |
仅除去铝 |
| II.将试管静置,弃去上层清液,加入足量的稀硫酸. | 有气泡产生(或固体减少或产生浅绿色溶液). |
证明含有铁 |
| III.将试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
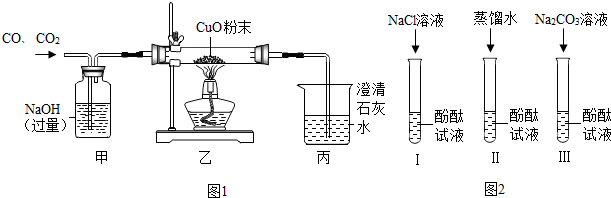
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 金属与人类的生活和生产密切相关.
金属与人类的生活和生产密切相关.| 实验步骤 | 现象和结论 | 有关反应的化学方程式 |
| 取少量滤纸上剩余的物质置于试管中,向其中滴加适量的 |
||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验操作 | 实验现象 | 结论 |
| I.取少量的金属粉末于试管中,加入足量的______(填试剂名称). | ______ | 仅除去铝 |
| II.将试管静置,弃去上层清液,加入足量的稀硫酸. | ______ | 证明含有铁 |
| III.将试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
查看答案和解析>>
科目:初中化学 来源:2013年江苏省南通市中考化学模拟试卷(四)(解析版) 题型:解答题

| 实验操作 | 实验现象 | 结论 |
| I.取少量的金属粉末于试管中,加入足量的______(填试剂名称). | ______ | 仅除去铝 |
| II.将试管静置,弃去上层清液,加入足量的稀硫酸. | ______ | 证明含有铁 |
| III.将试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com