
分析 (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
(4)碳酸钙的质量=石灰石样品的质量×碳酸钙的含量
解答 解:(1)碳酸钙相对分子质量为40+12×3+16×3=100.
(2)碳酸钙中钙、碳、氧元素的质量比为40:12:(16×3)=10:3:12.
(3)碳酸钙中钙元素的质量分数是$\frac{40}{100}$×100%=40%;
200g碳酸钙中所含钙元素的质量为200g×40%=80g;
(4)200g石灰石样品中碳酸钙的质量为200g×90%=180g
石灰石中钙元素的质量为180g×40%=72g
故答案为:(1)100;(2)钙、碳、氧元素的质量比为10:3:12;(3)80g;(4)72g.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:初中化学 来源: 题型:实验探究题
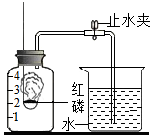 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子和原子在化学变化中都可以再分 | |
| B. | 钠原子和钠离子化学性质相同 | |
| C. | 分子、原子、离子都是构成物质的粒子 | |
| D. | 水中含有氢分子,所以电解水生成氢气 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
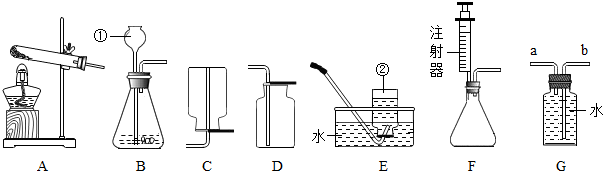

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
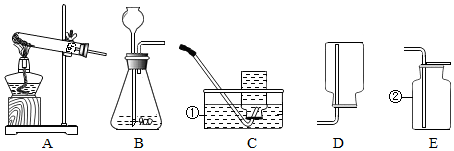
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/mL | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  标签受损 | B. |  不会产生氧气 | C. |  灯内酒精燃烧 | D. |  量得的液体偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com