

| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀H2SO4过量 |
分析 (1)根据酚酞遇碱变红色分析,根据反应物、生成物写出化学方程式;
(2)根据生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀和石蕊试液遇酸变红色以及活泼金属与酸反应生成氢气填写.
解答 解:(1)酚酞遇碱变红色,所以氢氧化钠溶液使酚酞试液变红;氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O.
(2)因为NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4,而石蕊试液遇酸变红色,所以方案二正确,因为活泼金属与酸反应生成氢气,所以可以加入锌粒等活泼金属(或碳酸钠等),若有气体放出,证明稀硫酸过量,反之稀硫酸不过量;
故答案为(1)红;2NaOH+H2SO4=Na2SO4+2H2O;
(2)③方案二;④NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4;⑤锌粒(或碳酸钠等).
点评 本题考查了酸碱中和反应,要完成此题可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 取少量试液于试管中,加入用HNO3酸化的BaCl2溶液,产生白色沉淀 | 说明试液中一定含有SO42- |
| B | 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一支试管中加入少量MnO2 | 研究催化剂对过氧化氢分解速率的影响 |
| C | 将NaHCO3与HCl两种溶液相互滴加 | 可以鉴别这两种溶液 |
| D | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有无色液滴产生,该气体是CH4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
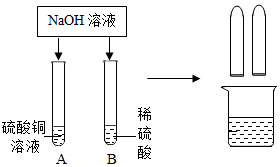 某化学小组在探究碱的化学性质时,做了如图所示的两个实验.
某化学小组在探究碱的化学性质时,做了如图所示的两个实验.| 实验内容 | 预计现象 | 预计结论 |
| (1)取少量滤液于试管中,观察 | 溶液呈无色 | 猜想甲不成立 |
| (2)继续在上述试管中加入硫酸铜溶液 | 产生蓝色沉淀 | 猜想丙成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验序号 | V饱和石灰水/mL | V蒸馏水/mL | 出现现象所需时间/s | |||
| 开始浑浊 | 明显浑浊 | 沉淀减少 | 是否澄清 | |||
| ① | 50 | 0 | 19 | 56 | 366 | 持续通入CO28min以上,沉淀不能完全消失 |
| ③ | 30 | 20 | 25 | 44 | 128 | |
| ④ | 20 | 30 | 27 | 35 | 67 | 89s后完全澄清 |
| ⑤ | 10 | 40 | 通3min以上,均无明显现象 | |||
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 猜想 | 可行的实验方案 | 观察到的实验现象 |
| 猜想① | 将一小块果肉浸入盛有蒸馏水的烧杯中,观察现象. | 果肉表面不变色. |
| 猜想② | 将一小块果肉放入盛有氧气的集气瓶中,观察现象. | 果肉表面变色. |
| 猜想③ | 将一小块果肉放入盛有氮气的集气瓶中,观察现象. | 果肉表面不变色. |
| 猜想④ | 将一小块果肉放入盛有二氧化碳的集气瓶中,观察现象. | 果肉表面不变色. |
| 猜想⑤ | 将两块一样的果肉分别放入盛有氧气的集气瓶中,将其中的一个集气瓶放入热水中,观察现象 | 温度高的先变色. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com