
��ҵ�̷�����Ҫ�ɷ�FeSO4��7H2O�������������������ʲ�����Ԫ�ء�������ˮ������Ҳ���ֽ⡣��������������Ϊ18%���ϵĹ�ҵ�̷���������ӡ�øߵ�Fe3O4�ۡ�
һ��ԭ�Ϲ�ҵ�̷����������������ⶨ
��ȡ30g��������������Ʒ��ͼ1���¼��ȣ�ʹ����ȫ�ֽ⣬���������ͼ2�������ò������̽�������ⶨ��Ʒ����������������
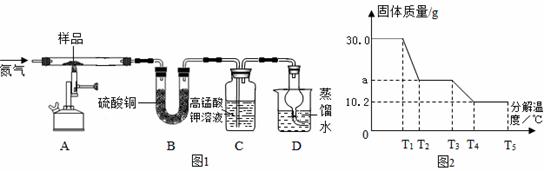
����������1���̷�������T1ʱ��ʼ�ֽ⣬T2ʱ��ȫʧȥˮ��T3ʱFeSO4��ʼ�ֽ⡣
��1��ʵ��ǰ��Ӧ�� �� ��
��2��װ��B������ͭ��ĩ������˵���������� �� ��װ��C�и��������Һ��ɫ��
˵�������л��� �� ��
��3��װ��A�й����ɺ���ɫ������ϡ���ᣬ�û�ɫ��Һ����ú���ɫ������ �� ��
��4��װ��D���θ���ܵ����� �� ��
��5���������Ϸ�����������������ֽ����SO3 ������������ݷ�������ͼ2��T3��T4���̵ķ�Ӧ��ѧ����ʽ �� ������Ʒ��������������= �� ��
��6��ʵ����Ҫ����ͨ�뵪�������������������������� �� ���ƫ����ƫС�����䡱�� ��
��
����������2��
�� ���������ڲ�ͬ�¶��µ��ܽ�����±���ʾ��
| �¶�/�� | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| �ܽ��/ g | 14��0 | 17��0 | 25��0 | 33��0 | 35��3 | 33��0 | 30��5 | 27��0 |
��Fe(OH)2��������4 Fe(OH)2 + 2H2O + O2 = 4 Fe(OH)3
�� ���Fe3O4�ķ�Ӧԭ��Ϊ��Fe(OH)2 + 2Fe(OH)3  Fe3O4 + 4H2O
Fe3O4 + 4H2O
��1���ܽ�ʱ����50����80�����ˮĿ���� �� ��
��2��д����������NaOH��Һʱ������Ӧ�Ļ�ѧ����ʽ �� ��
��3������ƷP�Ļ�ѧʽ�� �� ��
��4������M��ϴ���������Ƿ�ϴ���ķ����� �� ��
��5�� �������в�����Fe(OH)2��Fe(OH)3��������Ϊ50��107�������ò�Ʒ�� �� ��Fe3O4���������������������
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʵ��ᴿ�����Լ�����Ҫʵ���������ȷ����
| ����(������Ϊ����) | �����Լ� | ��Ҫʵ����� | |
| A | H2O(H2O2) | MnO2 | ���� |
| B | CaCl2(NaCl) | ����Na2CO3��Һ |
|
| C | CO2(CO) | ����O2 | ��ȼ |
| D | Al(Al2O3) | ����ϡH2SO4 | �ܽ⡢���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʳ�������������������йص���
A����ƿ�������ڴ�ζʮ�� B�������ڳ�ȥ��ˮƿ�е�ˮ��
C����ijЩ���Ӷ�ҧ��Ϳʳ�������ⶾ D����ʹ��̹����������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и�����Һ�����������Լ����ܼ����������
A��NaOH��Na2CO3����̪��CaCl2 B��ϡHCl��Na2CO 3��BaCl2��Na2SO4
3��BaCl2��Na2SO4
C��Na2SO4��Ba(OH)2��KNO3��NaCl D��CuSO4��NaOH��BaCl2��Ba(NO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij������CuS��ȡCuSO4��������������Ҫ���̣�
��1��CuS�ڿ����и������գ�����һ�ֺ�ɫ�����һ���д̼������塣
��2������ɫ�����һ�ֳ����ᷴӦ�Ƶ�CuSO4��
���������еķ�Ӧ��ѧ����ʽ�ǣ�1�� �� ����2��  �� ��
�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ�������ռ�һƿԼ�� ���������������в�����ȷ���ǣ�������
���������������в�����ȷ���ǣ�������
|
|
|
|
|
| A������ƿ�й� | B������ƿ�й� | C���������뵽����ƿ����� | D���������뵽����ƿ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ص��ܽ�������ʾ�������й�������ȷ���ǣ�������
| �¶�/�� | 20 | 30 | 40 | 50 | 60 |
| �ܽ��/(g/100 gˮ) | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
 A��20��ʱ�������50 g 35%������ر�����Һ
A��20��ʱ�������50 g 35%������ر�����Һ
B��30���50��ʱ��������������ر�����Һ������ˮ�������ǰ�ߴ��ں���
C��40��ʱ��50 g����ر�����Һ������20�棬�������������Ϊ32.3 g
D��60��ʱ��50 g����ر�����Һ�У��������ܼ���������Ϊ11��21
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ҫ����д�������ݣ�
(1).2�������� ����������� ��
(2).����������Ԫ�أ�O.H.Ca.Cl��д��ѧʽ���� ���� ��
(3).������������Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com