
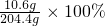 ≈5.2%
≈5.2%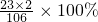 =4.6g
=4.6g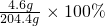 ≈2.3%
≈2.3%

科目:初中化学 来源: 题型:阅读理解
 做菜用的一种嫩肉粉,其主要成分是碳酸氢钠.小明发现将拌了嫩肉粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气泡.他对此颇感兴趣,决定对其进行探究.
做菜用的一种嫩肉粉,其主要成分是碳酸氢钠.小明发现将拌了嫩肉粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气泡.他对此颇感兴趣,决定对其进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
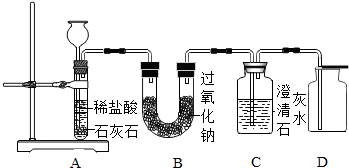 (2012?息县二模)金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2═2Na2CO3+O2.为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.
(2012?息县二模)金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2═2Na2CO3+O2.为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源:北京名校精典初中化学习题集 题型:038
有氢气、一氧化碳、二氧化碳的混合气体8g,通过盛有澄清石灰水的广口瓶,广口瓶增重4.4g.经干燥后把剩余气体通入灼热的氧化铁中,完全反应后先将产物通过盛氯化钙的干燥管,干燥管增重7.2g.再通入澄清石灰水中,产生10g沉淀(假设每个过程中气体都被完全吸收).求混合气中三种成分的质量分数?
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省南京市白下区中考一模化学试题(解析版) 题型:填空题
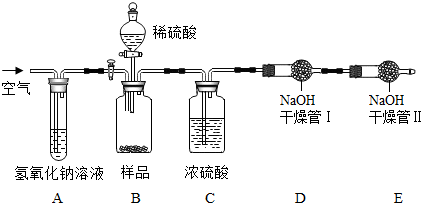
根据下列装置图,回答有关问题:

(1)利用上图中A、C装置的组合可以制取某种气体,实验室制取该气体的化学方程式是 ,验满方法是 。
(2)实验室通常利用上图中 装置的组合制取二氧化碳(选填字母),该反应的化学方程式为 。
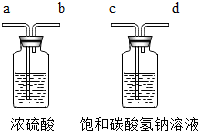
①为了得到纯净、干燥的二氧化碳气体,除杂装置(如下图)的导管按气流方向连接顺序是 (选填字母)。

A.a→b→c→d B.b→a→c→d
C.c→d→a→b D.d→c→b→a
②常用澄清石灰水检验二氧化碳的存在,该反应的化学方程式为 ;若二氧化碳过量,二氧化碳又会与碳酸钙、水反应生成易溶的碳酸氢钙[Ca(HCO3)2],该反应的化学方程式为 。向含有氢氧化钙14.8g的石灰水里缓缓通入一定量二氧化碳,充分反应后若生成10g沉淀,则通入二氧化碳的质量可能为 (选填字母)。
A.4.4g B.8.8g C.13.2g D.17.6g
【解析】:(1)如果用高锰酸钾或氯酸钾就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气;氧气不易溶于水,密度比空气的密度大,因此可以用排水法和向上排空气法收集;氧气的验满方法是:将带火星的木条靠近集气瓶口,若木条迅速复燃,证明已收集满氧气.
(2)实验室是在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集;二氧化碳是用石灰水来检验的,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;二氧化碳过量,二氧化碳又会与碳酸钙、水反应生成易溶的碳酸氢钙;如果二氧化碳的量比较少,那么一份二氧化碳生成一份碳酸钙,即44 /x =100/ 10g x=4.4g;如果氢氧化钙完全反应,那么氢氧化钙消耗二氧化碳的质量是8.8g,生成沉淀20g,由题意知,其中10g沉淀又与4.4g二氧化碳反应生成了碳酸氢钙,因此此时二氧化碳的质量=8.8g+4.4g=13.2g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com