
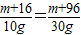

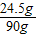 ×100%=27.2%
×100%=27.2%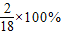 ):(7×
):(7×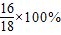 +3×
+3×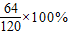 )=70:704≈1:10
)=70:704≈1:10

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:初中化学 来源:2011年北京市密云县中考化学一模试卷(解析版) 题型:选择题
查看答案和解析>>
科目:初中化学 来源:2011年湖北省荆州市中考化学调研试卷(解析版) 题型:填空题
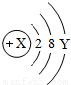 ,已知该粒子在化学反应中易得到2个电子形成稳定结构,Y=,X=.该元素形成的一种酸是一种重要的化工原料,在稀释这种浓酸时,一定要把沿器壁慢慢地注入,并不断搅拌.否则,会使酸液向四周飞溅,导致实验事故发生.
,已知该粒子在化学反应中易得到2个电子形成稳定结构,Y=,X=.该元素形成的一种酸是一种重要的化工原料,在稀释这种浓酸时,一定要把沿器壁慢慢地注入,并不断搅拌.否则,会使酸液向四周飞溅,导致实验事故发生.查看答案和解析>>
科目:初中化学 来源:2011年湖北省荆州市中考化学调研试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com