
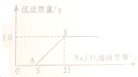
 小华用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取CO2.实验完毕,他的同伴小阳决定用实验后的废液,测定桌上另一瓶Na2CO3溶液的溶质质量分数.小阳将废液过滤后,向滤液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
小华用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取CO2.实验完毕,他的同伴小阳决定用实验后的废液,测定桌上另一瓶Na2CO3溶液的溶质质量分数.小阳将废液过滤后,向滤液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.| 106 |
| x |
| 100 |
| 5g |
| 5.3g |
| 25g-5g |


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:058
小华用碳酸钙和稀盐酸反应制取二氧化碳气体.若要制取二氧化碳
8.8g,求:(1)
消耗碳酸钙的质量多少克?(2)
若改用含杂质(杂质不参与反应)20%的石灰石来制取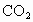 ,需石灰石多少克?
,需石灰石多少克?查看答案和解析>>
科目:初中化学 来源: 题型:
小华同学一家从三峡搬迁到我们家乡后,他爸爸准备兴建一座碳酸钙精粉厂。为检测当地石灰石中碳酸钙的纯度,他在实验室用6克石灰石样品(杂质不参加反应)与19克稀盐酸恰好完全反应,测得残留物为22.8克。
求:(1)根据质量守恒定律,生成二氧化碳 克;
(2)样品中碳酸钙的纯度;
(3)所用盐酸溶液中溶质的质量分数。(精确到0.1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com