(2006?陕西)质量分数是7.3%的稀盐酸滴入盛有10g 氢氧化钠溶液(滴有2滴酚酞试液)的烧杯中,恰好完全反应时消耗此稀盐酸的质量为5g,回答并计算:
(1)恰好完全反应时的现象是______.
(2)求此NaOH溶液中溶质的质量.
(3)求所得溶液中溶质的质量分数(酚酞试液质量不计).
【答案】
分析:(1)恰好完全反应时,溶液由碱性变成中性;
(2)根据盐酸与氢氧化钠发生中和反应的化学方程式,可由完全中和时消耗HCl的质量计算NaOH溶液中溶质的质量;
(3)由中和反应消耗HCl的质量计算出生成氯化钠的质量,由质量守恒定律计算出中和后溶液的质量,利用溶质质量分数计算公式计算所得溶液中溶质的质量分数.
解答:解:(1)当盐酸与氢氧化钠恰好完全反应时,溶液变为氯化钠溶液,溶液呈中性,酚酞遇中性溶液呈无色;
故答案为:溶液由红色变成无色;
(2)(3)设氢氧化钠溶液中溶质的质量为x,生成氯化钠的质量为y
NaOH+HCl═NaCl+H
2O
40 36.5 58.5
x 5g×7.3% y
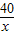
=
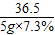
=
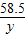
x=0.4g
y=0.585g
所得溶液的质量分数=
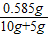
×100%=3.9%
答:氢氧化钠溶液中溶质的质量为0.4g,所得溶液中溶质的质量分数为3.9%.
点评:根据质量守恒定律,反应后所得溶液质量等于恰好中和时稀盐酸的质量与氢氧化钠溶液的质量和.

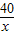 =
=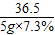 =
=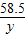
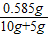 ×100%=3.9%
×100%=3.9%
