
���� ��1��Ҫ��ⶨͭ���������������ڸ�������ϡ���ᣬ���Ա�������һ�ֳɷ��ܹ������ᷴӦ��
��2���������ɵ������������Ͷ�Ӧ�Ļ�ѧ����ʽ����μӷ�Ӧ��п����������������ͭ������������
��� �⣺
��1��Ҫ��ⶨͭ���������������ڸ�������ϡ���ᣬ���Ա�������һ�ֳɷ��ܹ������ᷴӦ��Cu-Zn�Ͻ���ͭ���ܺ����ᷴӦ������п�ܺ����ᷴӦ�����Կ��Բⶨͭ��������������Cu-Au�Ͻ�ͭ�ͽ��ܺ����ᷴӦ���������ⶨ��ͭ������������
��2���ܲⶨͭ�����������ĺϽ�ΪCu-Zn�Ͻ�
��μӷ�Ӧ��п������Ϊx��
Zn+H2SO4=ZnSO4+H2��
65 2
x 0.2g
$\frac{65}{2}$=$\frac{x}{0.2g}$
x=6.5g
�úϽ���ͭ����������Ϊ$\frac{32.5g-6.5g}{32.5g}$��100%=80%
�𣺣�1��������ѧϰ�Ļ�ѧ֪ʶ������Ϊ���ܲ��ͭ�����������ĺϽ��� Cu-Au�Ͻ������� Cu��Au�����ܺ����ᷴӦ��
��2���úϽ���ͭ����������Ϊ80%��
���� ���ݻ�ѧ����ʽ����ʱ����һҪ��ȷ��д��ѧ����ʽ���ڶ�Ҫʹ����ȷ�����ݣ������������Ҫ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ����ȫ���м�����������ʡ������2017����꼶�п�ģ�⻯ѧ�Ծ� ���ͣ�ѡ�������
�����к���0.93%������Щ��ֻ�����������У��������к�����[CO(NH2)2]����������Ϊ�� ��
A. 0.20% B. 1.00% C. 1.99% D. 0.02%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ƹ�ʹ������ϴ�·ۣ������ڱ���ˮ��Դ | |
| B�� | ��ͨ�����˵ķ�����ȥ����Ⱦˮ�е��ж������Ա� | |
| C�� | ��ǿ��ҵ��ˮ���ŷż�أ���־����������ŷ� | |
| D�� | ����ʩ��ũҩ�����ʣ��Լ���ˮ����Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ʯ�Һ���ʯ�� | B�� | ���Ϸʣ�����غ�̼��� | ||
| C�� | Ӳ ˮ������ˮ�Ϳ�Ȫˮ | D�� | ̼���ʣ����ʯ��ʯī |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
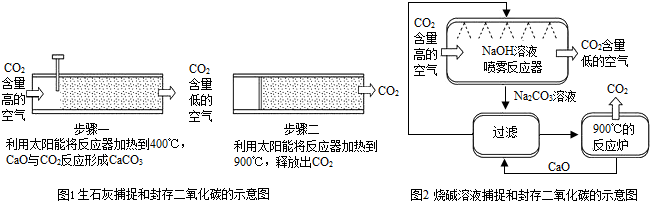
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com