
【题目】下列物质由地壳中含量最多的金属元素、非金属元素和空气中含量最多的元素组成是
A.CaCO3 B.Al2(SO4)3 C.Al(NO3)3 D.Fe(OH)3
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】下列数据是相应物质的pH,其中呈碱性的是
A.液体肥皂(9.5-10.5) B.菠萝汁(3.3-5.2)
C.柠檬汁(2.0-3.0) D.酱油(4.0-5.0)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液,并对滤液的组成进行探究。
(1)锌和硝酸银溶液反应的化学方程式是________________。
(2)同学们对滤液中所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是:①溶质为________;②溶质为____________________ 。
(3)请你设计两种实验方案来验证以上猜想。
方案 | 实验操作 | 实验现象 | 结 论 |
方案一 | __________ | __________ | 猜想①成立 |
方案二 | ___________ | _________ | 猜想②成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和食品都是人类生存必需品,它们的安全问题影响到人类的生存、健康。
(1)2014年“世界水日”的主题是“水与能源”,下列关于此主题的做法正确的是(____)
A.任意排放未经处理的生活污水 B.加大农药的使用量,以减少昆虫的危害
C.禁止使用含磷洗衣粉 D.用硫酸铜给饮用水消毒
(2)长期饮用硬水对人体健康不利,生活中可用_________ 来区别硬水和软水;自来水生产可用氯气进行杀菌消毒,请将氯气与水反应的化学方程式补充完整:Cl2+H2O===HClO+________;高铁酸钠(Na2FeO4)是一种新型高效的净水剂,高铁酸钠中铁元素的化合价为________。
(3)注意饮水安全,保证人体健康,在天然水净化过程中,人们常用活性炭去除异味色素,这是利用活性炭的_____性.此外还需加入二氧化氯进行杀菌和消毒,试写出二氧化氯的化学式_____。
(4)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式____________ ,在氢氧燃料电池中氢气和氧气反应又可以生成水,此过程中能量转化的形式是化学能转化为_______能。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2011年我国女科学家屠呦呦发现青蒿素(化学式:C15H22O5),它是一种用于治疗疟疾的特效药物,2015年获得诺贝尔奖.青蒿素由__ 种元素组成.一个青蒿素分子中含有 个原子.青蒿素中C、H、O三种元素的质量比为 ,
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据所学的知识并结合下列仪器,回答有关问题:

(1)写出仪器的名称B ,C 。
(2)实验室以氯酸钾为原料制取并收集氧气,完成这个实验除选用A、D、E、F,I外,还需增加的仪器是 ,反应的化学方程式为 。
(3)实验室用 为原料(填两种原料名称)来制取二氧化碳,组装一套发生装置所需的仪器 (填字母)。
(4)实验室还用Zn和稀H2SO4来制取氢气,反应的化学方程式为 。
(5)某同学制作的微型实验装置(夹持仪器略)。甲酸与热的浓硫酸反应的方程式为:![]()
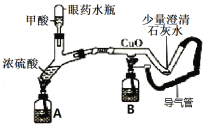
①则X是 (填化学式);
②实验开始时先要点燃A处酒精灯一段时间后,再点燃B处酒精的目的是 。
③此实验装置的主要优点是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将铁粉和铜粉混合物7.0g,加入到盛有60.0 g稀盐酸的烧杯中,恰好完全反应。此时烧杯内各物质的总质量为66.8 g。试计算:
(1)原混合物中铁粉的质量分数。(精确到0.1%)
(2)反应后所得溶液中溶质的质量分数。(精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳还原氧化铜的实验装置。某化学小组对该实验及产物的探究如下:
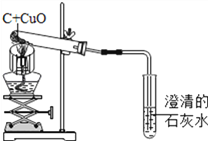
【分析】
(1)写出该反应的化学方程式_______________________。
(2)酒精灯加网罩的目的是_________________________。
(3)刚开始加热时,澄清石灰水中有气泡冒出,但澄清石灰水不变浑独,原因是_______________。
(4)实验结束应先_________。(选填答案序号)
A.撤离酒精灯 B.将导管移出石灰水. C.拨掉橡胶塞
【探究一】检验产物成分
【提出问题】:实验产物是暗红色固体,很难观察到紫红色固体,暗红色固体是什么?
【查阅资料】:氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4 =CuSO4 +Cu + H2O。
【猜想与假设】:暗红色固体除铜外还可能含有Cu2O
【设计实验】
(5)操作:取少量暗红色固体,加入稀硫酸,观察到现象:___________、_____________。结论:暗红色固体含有Cu2O。
【探究二】测定产物中Cu2O的含量
(6)为测定红色固体中氧化亚铜的质量分数,小组同学设计了如下两种方案:
甲方案:甲同学称取10g红色固体加人到足量稀硫酸中使其充分反应后,过滤_______(填操作名称)、干燥、称量剩余红色固体的质量为8 g,则红色固体中氧化亚铜的质量分数为__________。
乙方案:实验原理:Cu2O +H2![]() 2Cu +H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略,碱石灰为氧化钙和氢氧化钠的混合物,通过测定反应前后装置d的质量达到实验目的。
2Cu +H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略,碱石灰为氧化钙和氢氧化钠的混合物,通过测定反应前后装置d的质量达到实验目的。
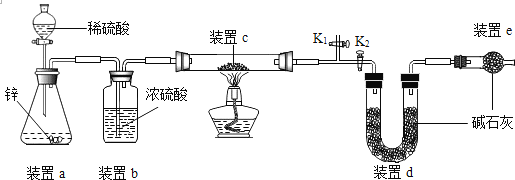
(7)装置a中用稀硫酸而不用稀盐酸,原因是_______________;
(8)若不加装置c,实验结果会偏_______(“大”或“小”),原因是_______________;
(9)点燃酒精灯前涉及的部分操作如下,正确的顺序是_____________;
①打开K2,关闭K1 ②检查装置的气密性 ③连接仪器 ④关闭K2,打开K1,通氢气一段时间
【拓展反思]】:
(10)还可通过测定反应前后装置________(填“a”、“b”、“c”)的质量达到测定产物中Cu2O的含量目的。
(11)乙方案第(9)的④中“通氢气一段时间”的目的是排出装置内的空气,否则可能带来哪些影响?__________、_____________(答出两点)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com